Hidrogen sulfurat
| Hidrogen sulfurat | |
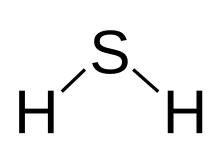 Formula structurală | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | Acid sulfhidric Sulfan |
| Identificare | |
| Număr CAS | 7783-06-4 |
| ChEMBL | CHEMBL1200739 |
| PubChem CID | 18779926 402, 18779926 |
| Informații generale | |
| Formulă chimică | H2S |
| Aspect | gaz cu miros de ouă clocite |
| Masă molară | 34,08 g/mol |
| Proprietăți | |
| Densitate | 1,5359 kg/m3 (0 °C) |
| Starea de agregare | gaz |
| Punct de topire | −85,7 °C |
| Punct de fierbere | −60,20 °C |
| Solubilitate | în apă (0 °C, 1 bar): 4,65 l/l, puțin solubil în solvenți organici |
| Presiune de vapori | 18,190 bar (20 °C) |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Hidrogenul sulfurat sau acidul sulfhidric este un acid anorganic slab. În stare pură este un gaz incolor, inflamabil, toxic, cu un miros puternic. Formula chimică H2S. Hidrogenul sulfurat este mai greu decât aerul, are o reacție ușor acidă, cu bazele formează săruri. Sărurile acidului sulfhidric se numesc sulfuri. Dizolvat in apă se numește acid sulfhidric.
În concentrație redusă are miros neplăcut de ouă clocite. În concentrație ridicată paralizează centrii respiratori. În funcție de concentrație și de durata de expunere poate produce efecte cronice sau acute. La concentrații peste 0.1% poate ucide în câteva secunde.
Răspândire
modificareÎn natură se poate găsi în regiunile cu gaze naturale, petrol sau cu vulcanism activ. Mai poate lua naștere prin procesele de putrefacție a substanțelor organice, în intestin, depozitele de gunoaie. În minerit gazul se formează prin putrezirea lemnului folosit la susținerea lucrărilor miniere. De asemenea, acidul sulfhidric mai este produs de bacterii în procesul de putrezire a biomasei (cadavre de animale, resturi de plante, fecale, gunoi menajer, etc.) Mai este prezent și pe fundul Mării Negre la o adâncime mai mare de 200 de metri. [2]
Sărurile sale, sulfurile, sunt foarte răspândite în natură sub formă de minerale și minereuri.
Obținere
modificareÎn petrochimie (rafinării) se obține în cantități mari din sulfură de fier (II) și acid clorhidric:
Utilizare
modificare- Sursă importantă de obținere a sulfului
- Reacții de identificare a unor substanțe chimice.
- Notă:
- Este un gaz mai greu ca aerul, foarte toxic mai ales pentru om, gazul se absoarbe prin mucoase, inhibă receptorii mirosului deja la concentrația de 250–300 ppm.
Proprietăți
modificareEste un gaz doar puțin mai greu decât aerul. Un litru de apă dizolvă la temperatura camerei 3 litri de hidrogen sulfurat gazos formând acidul sulfhidric[3]. În alcool solubilitatea e mai mare decât în apă de peste 3 ori.
Se poate oxida cu dioxid de sulf producându-se sulf elementar și monoxid de azot. Produce sulf elementar coloidal și prin reacție cu clor, brom și iod.
Hidrogenul sulfurat este foarte toxic. Deși mirosul său caracteristic este foarte puternic, acesta nu este permanent sesizabil, pe durata expunerii nasul obișnuindu-se cu el. Acțiunea sa toxică este una complexă, el afectând diverse funcții ale organismului. Cea mai importantă este cea asupra sângelui, unde, prin formarea unui complex cu fierul, blochează transportul oxigenului.
Note
modificare- ^ „Hidrogen sulfurat”, hydrogen sulfide (în engleză), PubChem, accesat în
- ^ Marea Neagră, invadată de o masă uriașă de hidrogen sulfurat antena3.ro, 27 Oct. 2010
- ^ Ripan, Ceteanu, p. 221
Bibliografie
modificare- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p 24
- D. Negoiu, Tratat de chimie anorganică, editura Tehnică, vol.2, București, 1972
- Raluca Ripan: Manual de lucrări practice de chimie anorganică- vol I - Metaloizi, Editura de Stat Didactică și Pedagogică, 1961, p. 218-228
- Raluca Ripan: Semimicroanaliza, Editura de Stat Didactică și Pedagogică, 1961
- Linus Pauling, Chimie generală, Editura Științifică, București, 1972 (traducere din limba engleză)
Vezi și
modificareLegături externe
modificare- Exploatarea hidrogenului sulfurat din Marea Neagră, un deranj mult prea mare Arhivat în , la Wayback Machine.