Cation
Cationul (grec. ἰόν [ión] = cel mișcător) este un ion încărcat electric pozitiv. Numele de cation provine de la comportarea sa în timpul procesului de electroliză, în care cationii se deplasează spre catod (polul negativ). Cationii pot proveni din atomi sau molecule, care au devenit încărcați pozitivi prin cedare de sarcini negative (electroni), sau prin acceptare de protoni, care sunt de fapt cationii hidrogenului (H+).[1]
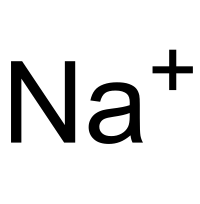
In compoziția sărurilor intră întotdeauna cationii (ionii pozitivi), și anionii (ionii negativi), între care există continu procese de transformare.
Dozarea cationilor în laborator se face prin metode din chimia analitică.
Exemple de cationi
modificare- Cationi proveniți din molecule:
- NH 4 +
- H3O +
- [NO] +
Încărcarea electrică a cationilor
modificareDe exemplu din atomul de sodiu ia naștere un cation de sodiu prin pierderea unui electron, pe când atomul de magneziu pierde doi electroni, iar atomul de aluminiu pierde trei electroni, prin care devine de trei ori mai încărcat pozitiv ca și atomul de sodiu.
- Na → Na + + 1e -
- Mg → Mg 2+ + 2e -
- Al → Al 3++ 3e -
În cazul metalelor ionii se grupează într-o configurație de înveliș electronic, schimbul de electroni se produce ca urmare a tendinței fiecărui atom de a-și forma configurația straturilor de electroni după modelul gazelor nobile (heliu, neon, argon, etc.)
Numărul de electroni cedați depinde de numărul electronilor de pe ultimul strat, care în tabelul sistemului periodic al elementelor determină grupa principală în care este încadrat în tabel elementul respectiv.
Note
modificare- ^ „7.3: Cations”, Chemistry LibreTexts, , accesat în
Bibliografie
modificareI.G. Murgulescu, O. M. Radovici Introducere în chimia fizică vol IV Electrochimia Editura Academiei, București, 1986