Element chimic
Prin noțiunea de element chimic se înțelege o specie de atomi identici, adică de atomi având același număr de protoni în nucleul atomului, respectiv un număr identic de electroni în învelișul electronic al atomului. Definiția nu se referă la numărul de neutroni din nucleu, ceea ce înseamnă că noțiunea de element chimic include toți izotopii acelui element chimic.
Savantul rus Dimitri I. Mendeleev a descoperit legea periodicității elementelor chimice și a conceput o reprezentare grafică a interdependenței sofisticate a tuturor speciilor unice de atomi, tabelul periodic al elementelor.
Sunt identificate 118 elemente, dintre care primele 94 apar natural pe Pământ, restul fiind elemente sintetice.[1] Există 80 de elemente care au cel puțin un izotop stabil și 38 care au exclusiv radionuclizi, care se descompun în timp în alte elemente. Fierul este cel mai abundent element (ca masă) care formează Pământul, în timp ce oxigenul este cel mai frecvent element din crusta Pământului.
Elementele chimice constituie toată materia obișnuită a universului. Cu toate acestea, observațiile astronomice sugerează că materia observabilă obișnuită reprezintă doar aproximativ 15% din materia din univers: restul este materia întunecată; compoziția acestei materii este necunoscută, dar nu este compusă din elemente chimice. Cele două elemente mai ușoare, hidrogen și heliu, au fost formate în cea mai mare parte în Big Bang și sunt cele mai comune elemente din univers. Următoarele trei elemente (litiu, beriliu și bor) au fost formate în mare parte prin spalarea cu radiație cosmică (nucleosinteză) și, prin urmare, sunt mai rare decât elementele mai grele. Formarea elementelor de la 6 până la 26 de protoni a apărut și continuă să apară în stelele secvenței principale prin nucleosinteză stelară. Abundența mare de oxigen, siliciu și fier pe Pământ reflectă producția lor obișnuită în astfel de stele. Elementele cu mai mult de 26 de protoni se formează prin nucleosinteza în supernove, care, atunci când explodează, aruncă aceste elemente ca rămășițe departe în spațiu, unde pot ajunge încorporate în planete atunci când sunt formate.
Termenul "element" este utilizat pentru atomii cu un număr dat de protoni (indiferent dacă sunt sau nu ioni sau legați chimic, de exemplu, hidrogenul din apă), precum și pentru o substanță chimică pură care constă dintr-un singur element (de exemplu, hidrogen gazos). Pentru al doilea sens, au fost sugerați termenii "substanță elementară" și "substanță simplă", dar nu s-au bucurat de multă acceptare în literatura chimică engleză, în timp ce în alte limbi echivalentul lor este utilizat pe scară largă. Un singur element poate forma mai multe substanțe care diferă în structura lor; ele sunt numite alotropi ai elementului.[2]
Atunci când diferite elemente sunt combinate chimic, cu atomii deținuți împreună prin legături chimice, ele formează compuși chimici. Numai o mică parte a elementelor se găsește nemodificată ca minerale relativ pure. Printre elementele native mai frecvente se numără cuprul, argintul, aurul, carbonul (sub formă de cărbune, grafit sau diamante) și sulful. Toate, cu excepția câtorva dintre cele mai inerte elemente, cum ar fi gazele nobile și metalele nobile]], se găsesc de obicei pe Pământ în formă combinată chimic, ca și compuși chimici. În timp ce aproximativ 32 de elemente chimice apar pe Pământ în forme necombinate native, cele mai multe dintre acestea apar ca amestecuri. De exemplu, aerul atmosferic este în primul rând un amestec de azot, oxigen și argon, iar elementele solide native apar în aliaje, cum ar fi cele de fier și nichel.
Istoria descoperirii și utilizării elementelor a început cu societăți primitive umane care au găsit elemente native precum carbon, sulf, cupru și aur. Civilizațiile ulterioare au extras din minereurile lor, prin topire, cupru, staniu, plumb și fier, prin utilizarea cărbunelui. Alchimiștii și chimiștii au identificat ulterior mult mai multe; aproape toate elementele naturale au fost cunoscute până în 1900.
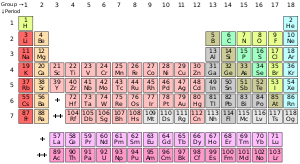
Proprietățile elementelor chimice sunt rezumate în tabelul periodic al elementelor, care organizează elementele prin creșterea numărului atomic pe rânduri ("perioadele") în care coloanele ("grupurile") au proprietăți fizice și chimice recurente ("periodice"). Cu excepția elementelor radioactive instabile cu timpi de înjumătățire scurți, toate elementele sunt disponibile din punct de vedere industrial, majoritatea în grade scăzute de impurități.[2]
Scurt istoric
modificareConceptul de atom (în greaca veche atomos, adică indivizibil) poate fi întâlnit în lucrările filosofilor greci antici Leucip și Democrit. Din punct de vedere pur abstract, speculativ, fără ca știința și tehnica timpului lor să le fi oferit sprijin experimental, Leucip și Democrit ajung la concluzia logică și filozofică că există o limită inferioară de divizare a materiei, și anume, această limită se oprește la o particulă, extrem de mică, dar indivizibilă, pe care au numit-o atom.
Descriere
modificareCele mai ușoare elemente chimice sunt hidrogenul și heliul[1], ambele create de nucleosinteza Big Bang în primele 20 de minute ale universului[3] in într-un raport de aproximativ 3: 1 în masă (sau 12: 1 în număr de atomi)[4][5], împreună cu urme minuscule ale următoarelor două elemente, litiu și beriliu.[6] Aproape toate celelalte elemente găsite în natură au fost create prin diferite metode naturale de nucleosinteză[7]. Pe pământ, cantități mici de atomi noi sunt produse în mod natural în reacții nucleogene sau în procese cosmogene, cum ar fi spalarea cu raze cosmice. Atomii noi sunt, de asemenea, produși natural pe Pământ ca izotopi radiogeni ai fiilor proceselor de dezintegrare radioactivă în curs de desfășurare, cum ar fi dezintegrarea alfa, dezintegrarea beta, fisiunea spontană, dezintegrarea clusterului și alte moduri mai rare de dezintegrare.
Dintre cele 94 de elemente naturale, cele cu numere atomice de la 1 la 82 au fiecare cel puțin un izotop stabil (cu excepția technețiului, elementul 43, și promețiu, elementul 61, care nu au izotopi stabili). Izotopii considerați stabili sunt aceia pentru care nu a fost încă observată dezintegrarea radioactivă. Elementele cu numerele atomice de la 83 până la 94 sunt instabile până la punctul în care se poate detecta dezintegrarea radioactivă a tuturor izotopilor. Unele dintre aceste elemente, în special bismut (număr atomic 83), toriu (număr atomic 90) și uraniu (număr atomic 92), au unul sau mai mulți izotopi cu jumătăți de viață suficient de lungi pentru a supraviețui ca rămășițe ale nucleosintezei stelare explozive care au produse metale grele înainte de formarea sistemului nostru solar. Cu peste 1,9×1019 ani, de peste un miliard de ori mai mare decât vârsta estimată a universului, bismutul-209 (numărul atomic 83) are cel mai lung timp de înjumătățire la dezintegrarea alfa față de oricare element natural, și este aproape întotdeauna considerat la egalitate cu cele 80 de elemente stabile[8][9]. Elementele cele mai grele (cele dincolo de plutoniu, elementul 94) suferă dezintegrare radioactivă, cu jumătăți de viață atât de scurte încât nu se găsesc în natură și trebuie sintetizate.
Începând cu anul 2010, există 118 elemente cunoscute[10][11] (în acest context, "cunoscut" înseamnă observat suficient de bine, chiar din doar câteva produse de dezintegrare, care au fost diferențiate de alte elemente)[12][13]. Dintre aceste 118 elemente, 94 apar natural pe Pământ. Șase dintre acestea apar în cantități extreme: technețiu, număr atomic 43; promețiu, numărul 61; astatiniu , numărul 85; franciu , numărul 87; neptuniu, numărul 93; și plutoniu, numărul 94. Aceste 94 de elemente au fost detectate în univers în general, în spectrul stelelor și supernovelor, unde sunt create elemente radioactive cu durată scurtă de viață. Primele 94 de elemente au fost detectate direct pe Pământ ca nuclizi primordiali prezenți din formarea sistemului solar sau ca produse de fisiune sau transmutație apărute în mod natural de uraniu și toriu.
Celelalte 24 de elemente mai grele rămase, care nu se găsesc astăzi nici pe Pământ, nici în spectrul astronomic, au fost produse artificial: toate acestea sunt radioactive, cu jumătăți foarte scurte de viață; dacă există vreun atom al acestor elemente la formarea Pământului, este extrem de probabil, până la punct de certitudine, că au fost deja dezintegrate și, dacă sunt prezente în nove, au fost în cantități prea mici pentru a fi observate. Technețiul a fost primul element sintetizat, care nu a fost natural, în 1937, deși în natură s-au găsit urme de technețiu (și, de asemenea, elementul a fost descoperit în mod natural în 1925)[14]. Acest model al producției artificiale și descoperirea naturală ulterioară a fost repetat cu mai multe alte elemente rare, radioactive, naturale.[15]
Specii de atomi
modificareIzotopi
modificareIzotopii sunt specii de atomi cu același Z (număr atomic), dar cu număr de masă (A) diferită, sau specii de atomi cu aceeași sarcină nucleară și număr diferit de neutroni. Exemplul hidrogenului:
| PROTIU (H) | DEUTERIU (D) | TRITIU (T)-radioactiv |
|---|---|---|
| Z=1, A=1 | Z=1, A=2 | Z=1, A=3 |
| 1 proton | 1 proton | 1 proton |
| 0 neutroni | 1 neutron | 2 neutroni |
| 1 electron | 1 electron | 1 electron |
Izobari
modificareIzobarii sunt specii de atomi care aparțin unor elemente chimice diferite, dar care au același număr de nucleoni. Izobarii au număr atomic (Z) diferit, dar au același număr de masă (A). Ca exemplu poate servi seria izobarică 40, care cuprinde atomi cu câte 40 de nucleoni, după cum se observă în tabelul de mai jos:
Izotoni
modificareIzotonii sunt specii de atomi cu același număr de neutroni (n), dar cu număr diferit de protoni (Z).
Note
modificare- ^ a b „Elemente chimice”. SetThings.com. . Accesat în .
- ^ a b Sfetcu, Nicolae (). Materia: Solide, Lichide, Gaze, Plasma - Fenomenologie. MultiMedia Publishing. ISBN 978-606-9016-12-1.
- ^ Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Sagaidak, R.; Shirokovsky, I.; Tsyganov, Yu.; et al. (). „Evidence for Dark Matter” (PDF). Physical Review C. 74 (4): 044602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602. Arhivat din original (PDF) la . Accesat în .
- ^ lbl.gov (). „The Universe Adventure Hydrogen and Helium”. Lawrence Berkeley National Laboratory U.S. Department of Energy. Arhivat din original la .
- ^ astro.soton.ac.uk (). „Formation of the light elements”. University of Southampton. Arhivat din original la .
- ^ „Elemente chimice”. SetThings.com. . Accesat în .
- ^ foothill.edu (). „How Stars Make Energy and New Elements” (PDF). Foothill College.
- ^ Dumé, B. (). „Bismuth breaks half-life record for alpha decay”. Physicsworld.com. Bristol, England: Institute of Physics. Accesat în .
- ^ de Marcillac, P.; Coron, N.; Dambier, G.; Leblanc, J.; Moalic, J-P (). „Experimental detection of alpha-particles from the radioactive decay of natural bismuth”. Nature. 422 (6934): 876–8. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201.
- ^ Glanz, J. (). „Scientists Discover Heavy New Element”. The New York Times.
- ^ Oganessian, Yu. Ts.; Abdullin, F. Sh.; Bailey, P. D.; Benker, D. E.; Bennett, M. E.; Dmitriev, S. N.; Ezold, J. G.; Hamilton, J. H.; Henderson, R. A.; Itkis, M. G.; Lobanov, Yu. V.; Mezentsev, A. N.; Moody, K. J.; Nelson, S. L.; Polyakov, A. N.; Porter, C. E.; Ramayya, A. V.; Riley, F. D.; Roberto, J. B.; Ryabinin, M. A.; Rykaczewski, K. P.; Sagaidak, R. N.; Shaughnessy, D. A.; Shirokovsky, I. V.; Stoyer, M. A.; Subbotin, V. G.; Sudowe, R.; Sukhov, A. M.; Tsyganov, Yu. S.; et al. (aprilie 2010). „Synthesis of a New Element with Atomic Number Z=117”. Physical Review Letters. 104 (14): 142502. Bibcode:2010PhRvL.104n2502O. doi:10.1103/PhysRevLett.104.142502. PMID 20481935.
- ^ Sanderson, K. (). „Heaviest element made – again”. News@nature. doi:10.1038/news061016-4.
- ^ Schewe, P.; Stein, B. (). „Elements 116 and 118 Are Discovered”. Physics News Update. American Institute of Physics. Arhivat din original la . Accesat în .
- ^ United States Environmental Protection Agency. „Technetium-99”. epa.gov. Accesat în .
- ^ Harvard–Smithsonian Center for Astrophysics. „Origins of Heavy Elements”. cfa.harvard.edu. Accesat în .
Vezi și
modificare