Hirudină
Hirudina este o peptidă naturală din glandele salivare ale lipitorilor care se hrănesc cu sânge (cum ar fi Hirudo medicinalis), care are o proprietate de anticoagulant pentru sânge.[2] Acest lucru este fundamental pentru obiceiul lipitorilor de hrănire cu sânge, deoarece menține sângele care curge după inițiala puncție a pielii gazdei de către vierme.
| Hirudină | |||||||||
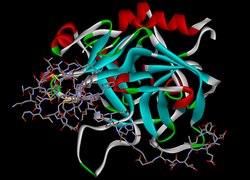
 Analiza cristalografică la rezoluția 3.0-angstroms a legării de trombina umană a patru inhibitori activi direcționați la fața locului | |||||||||
| Identificatori | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Symbol | Hirudină | ||||||||
| Pfam | PF00713 | ||||||||
| InterPro | IPR000429 | ||||||||
| SCOP2 | 4htc / SCOPe / SUPFAM | ||||||||
| |||||||||
Structura
modificareÎn timpul anilor petrecuți în Birmingham și Edinburgh, John Berry Haycraft a fost implicat activ în cercetare și a publicat lucrări privind coagularea sângelui, iar în 1884 a descoperit că lipitoarea secretă un anticoagulant puternic, pe care l-a numit hirudină, deși nu a fost izolat până în anii 1950, nici structura sa nu a fost pe deplin determinată până în 1976. Lungimea completă a hirudinei este formată din 65 de aminoacizi. Acești aminoacizi sunt organizați într-un domeniu compact N-terminal care conține trei legături disulfurice și un domeniu C-terminal care este complet dezordonat atunci când proteina este ne-complexată în soluție.[3][4] Reziduurile de aminoacizi 1-3 formează un beta-fir paralel cu reziduuri 214-217 din trombină, azot atom din reziduul 1 făcând o legătură de hidrogen cu Ser-195 O atom gamma al sitului catalitic. Domeniul C-terminal face numeroase interacțiuni electrostatice cu o legătură anion ozosit de trombină, în timp ce ultimele cinci reziduuri se află într-un loop helical care formează multe contacte hidrofobe.[5] Hirudina naturală conține un amestec de diferite izoforme ale proteinei. Cu toate acestea, tehnicile ADN-ului recombinant pot fi utilizate pentru a produce preparate omogene de hirudină.[6]
Activitatea biologică
modificareUn eveniment cheie în etapele finale ale coagulării sângelui este conversia fibrinogenului în fibrină de către enzima serina protează trombină.[7] Trombina este produsă din protrombină, prin acțiunea unei enzime, protrombinaza (Factor Xa împreună cu Factorul Va ca cofactor), în stările finale de coagulare. Fibrina este apoi încrucișată prin factorul XIII (Factor stabilizator fibrină) pentru a forma un cheag de sânge. Principalul inhibitor al trombinei în circulația normală a sângelui este antitrombină.[6] Similar cu antitrombina, activitatea anticoagulantă a hirudinei se bazează pe capacitatea sa de a inhiba activitatea procoagulantă a trombinei.
Hirudin este cel mai puternic inhibitor natural al trombinei. Spre deosebire de antitrombină, hirudina se leagă și inhibă numai trombina activată, cu o activitate specifică asupra fibrinogenului.[6] Prin urmare, hirudina previne sau dizolvă formarea cheagurilor și trombi (adică, are o activitate trombolitică] și are valoare terapeutică în să finule] în tratamentul pielii hematoms și al venei varicoases superficiale, fie ca cremă injectabilă, fie ca cremă de aplicare topică. În unele aspecte, hirudina are avantaje față de anticoagulantele și tromboliticele mai frecvent utilizate, ar fi heparina, deoarece nu interferează cu activitatea biologică a altor proteine serice, și poate acționa, de asemenea, asupra trombinei complexe.
Este dificil să extragem cantități mari de hirudină din surse naturale, astfel încât a fost dezvoltată o metodă de producere și purificare a acestei proteine folosind recombinant biotehnologie biotehnologie biotehnologie biotehnologie biotehnologie biotehnologie biotehnologie biotehnologie a fost dezvoltată. Acest lucru a condus la dezvoltarea și comercializarea unui număr de produse farmaceutice anticoagulante pe bază de hirudin, ar fi lepirudin (Refludan), hirudin derivat din Hansenula(Trombexx, Extrauma) și desirudin (Revasc/Ivrivask). Alte inhibitori directi ai trombinei sunt derivate chimic din hirudină.
Vezi și
modificareReferințe
modificare- ^ Bank, RCSB Protein Data. „RCSB PDB - 4HTC: THE REFINED STRUCTURE OF THE HIRUDIN-THROMBIN COMPLEX”. www.rcsb.org.
- ^ „IV. On the action of a secretion obtained from the medicinal leech on the coagulation of the blood”. Proceedings of the Royal Society of London. 36 (228–231): 478–487. . doi:10.1098/rspl.1883.0135 .
- ^ Folkers PJ, Clore GM, Driscoll PC, Dodt J, Köhler S, Gronenborn AM (). „Solution structure of recombinant hirudin and the Lys-47----Glu mutant: a nuclear magnetic resonance and hybrid distance geometry-dynamical simulated annealing study”. Biochemistry. 28 (6): 2601–2617. doi:10.1021/bi00432a038. PMID 2567183.
- ^ Haruyama H, Wüthrich K (mai 1989). „Conformation of recombinant desulfatohirudin in aqueous solution determined by nuclear magnetic resonance”. Biochemistry. 28 (10): 4301–4312. doi:10.1021/bi00436a027. PMID 2765488.
- ^ Rydel TJ, Ravichandran KG, Tulinsky A, Bode W, Huber R, Roitsch C, Fenton JW (). „The structure of a complex of recombinant hirudin and human alpha-thrombin”. Science. 249 (4966): 277–80. Bibcode:1990Sci...249..277R. doi:10.1126/science.2374926. PMID 2374926.
- ^ a b c Rydel TJ, Tulinsky A, Bode W, Huber R (). „Refined structure of the hirudin-thrombin complex”. Journal of Molecular Biology. 221 (2): 583–601. doi:10.1016/0022-2836(91)80074-5. PMID 1920434.
- ^ Fenton JW, Ofosu FA, Brezniak DV, Hassouna HI (). „Thrombin and antithrombotics”. Seminars in Thrombosis and Hemostasis. 24 (2): 87–91. doi:10.1055/s-2007-995828. PMID 9579630.
Legături externe
modificare