Plierea proteinelor
Plierea proteinelor este procesul fizic prin care o polipeptidă se pliază în structura sa caracteristică tridimensională.[1]
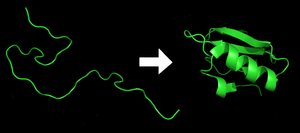
Fiecare proteină începe prin a fi o polipeptidă, obținută prin translație dintr-o secvență de ARNm ca o catenă liniară de aminoacizi. Această polipeptidă nu are structură tridimensională (partea stângă a imaginii alăturate). Totuși, se poate considera că toți aminoacizii din catenă au unele caractersitici chimice. Acestea pot fi, de exemplu, hidrofobe, hidrofile sau cu sarcină electrică. Datorită proprietăților, aminoacizii interacționează unii cu alții și cu mediul în care se află pentru a da o formă tridimensională, bine definită moleculei, numită proteină pliată sau stare nativă, astfel că structura tridimensională care rezultă este determinată de această secvență de aminoacizi.[2] Mecanismul plierii proteinelor nu este înțeles pe deplin.
Tehnici de studiere a plierii proteinelor
modificarePredicția computațională a structurii terțiare a proteinelor
modificareTehnicile de novo sau ab initio pentru predicția computațională a structurii proteinelor este legată, dar distinctă, de studiile asupra plierii proteinelor. Molecular Dynamics (MD) este o unealtă importantă pentru studierea plierii și dinamicii proteinelor in silico. Din cauza costului computațional, simulările de pliere ab initio MD explicite sunt limitate la peptide și proteine foarte mici. Simulările MD ale proteinelor mai mari rămân restricționate la dinamica structurii experimentale sau deplierea la temperatură înaltă. Pentru a simula procesele de pliere lungi (peste 1 microsecundă), precum plierea proteinelor de mărime mică (circa 50 de reziduuri) sau mai mare, sunt introduse unele aproximări sau simplificări. Metoda de a folosi reprezentarea redusă a proteinelor (se definesc pseudo-atomi reprezentând grupuri de atomi) și potențial statistic nu este de ajutor numai în predicția structurii proteinelor, dar și în stabilirea căilor de pliere.[3]
Tehnici pentru determinarea structurii proteinelor
modificareDeterminarea structurii pliate a unei proteine este un proces lung și complicat, care implică metode precum cristalografie cu raze X și RMN. Una din ariile de interes major este predicția structurii native pornind doar de la secvența de aminoacizi folosind bioinformatica și metode de simulare computațională.
Referințe
modificare- ^ Alberts, Bruce (). „The Shape and Structure of Proteins”. Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1.
- ^ Anfinsen C (). „The formation and stabilization of protein structure”. Biochem. J. 128 (4): 737–49. PMID 4565129.
- ^ Kmiecik S and Kolinski A (). „Characterization of protein-folding pathways by reduced-space modeling”. Proc. Natl. Acad. Sci. U.S.A. 104 (30): 12330–12335. PMID 17636132.
Format:Structura terțiară a proteinelor Format:Subiecte proteine