Porfină
| Porfină | |
 | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 101-60-0 |
| PubChem CID | 66868 |
| Formulă chimică | C₂₀H₁₄N₄[1] |
| Masă molară | 310,121846448 u.a.m. |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
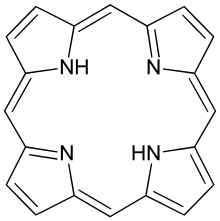
Porfina este un compus cristalin care nu se topește pînă la 360°, cînd începe să se descompună. Porfina a fost sintetizată prin încălzirea α-pirolaldehidei cu acid formic, sinteză realizată de H. Fischer în 1935.

Caracterul aromatic
modificareNucleul porfirinic este de tip polienic, cu structură plană, fapt confirmat de cristalografia cu raze X. Energia de conjugare de circa 250 kcal/mol, mult mai mare decît a celor patru nuclee, explică marea stabilitate chimică și caracterul aromatic. Sistemul aromatic este format din 22 electroni pi, dar numai 18 sunt delocalizați; nucleul porfirinic îndeplinește condiția stării aromatice impuse de regula lui Hückel (4n + 2 pi electroni unde n=2). Spectrul RMN a mezo protonilor (protonii implicați în punțile metilenice care leagă nucleele pirolice) au o valoare de 8-10 ppm, în timp ce semnalul electronilor de la N corespunde unei valori de -2-4 ppm.
Proprietăți fizico-chimice
modificarePorfina are o culoare roșie și absoarbe în banda 500-600 nm. Reacțiile de substituție electrofilă (nitrare sulfonare, alchilare) a porfinei scot în evidență caracterul său aromatic. Studiul cu raze X arată că cele patru nuclee pirolice sunt echivalente și coplanare, iar substituțiile au loc preponderent în poziția mezo. Pentru reacțiile chimice care necesită utilizarea de acizi se protejează atomul de azot prin cuplarea cu ioni metalici cu care formează complecși metalici. Ionii de Zn, Cd, Mg formează complecși care eliberează electronii către macrociclul porfirinic, dezavantajul ar fi că acești complecși pot fi ușor și rapid demetalizați, chiar în condițiile reacției. Ionii de Ni, Cu, Fe formează complecși mult mai stabili, cu toate că acești ioni scad densitatea electronică a macrociclului porfirinic.