Voltametru Hofmann
| Voltametrul lui Hofmann | |
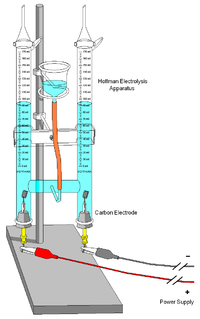 Un aparat de electroliză | |
| General | |
|---|---|
| Nume | Aparat de electroliză |
| Acronim | electrolizor |
| Utilizări | electroliză, pilă galvanică |
| Experiențe notabile | lui Faraday |
| Inventator | August Wilhelm von Hofmann |
| Model | alte echipamente |
| Compoziție | |
| Material | sticlă/plastic etc |
| Modifică text | |
Voltametrul Hofmann este un aparat de electroliză a apei, inventat în 1866 de August Wilhelm von Hofmann (1818-1892).
Compunere și funcționare
modificareSe compune din trei cilindri alăturați în poziție verticală, de obicei din sticlă. Cilindrul interior este deschis în partea de sus, pentru a permite adăugarea apei și a unui compus ionic pentru a îmbunătăți conductivitatea electrică, cum ar fi o cantitate mică de acid sulfuric. Câte un electrod de platină este plasat în interior în partea de jos a fiecăruia dintre cei doi cilindri laterali, conectați la bornele pozitivă și negativă ale unei surse de energie electrică. Când curentul trece prin voltametrul Hofmann, se formează oxigen la anod și hidrogen la catod. Fiecare dintre gaze dislocă apa și se adună în partea de sus a celor două tuburi laterale.
Nume
modificareNumele "voltametru" a fost inventat de către Daniell care prescurtat numele inițial de "Volta-electrometru" dat de Faraday. Voltametrele Hofmann nu mai sunt folosite ca dispozitive de măsurare electrice. Totuși, înainte de inventarea ampermetrelor voltametrele au fost deseori folosite pentru a măsura curentul, deoarece curentul printr-un voltametru cu electrozi de fier sau cupru plachează electric catodul cu o cantitate de metal transferat de la anod direct proporțională cu totalul sarcinilor electrice, în coulombi (legea lui Faraday de electroliză). Numele modern al aparatului este "coulombmetru electrochimic". Deși ortografierea corectă a numelui Hofmann conține doar un singur "f", aparatul este de multe ori incorect descris ca Hoffmann.
Utilizări
modificareCantitatea de energie electrică, care a trecut prin sistemul poate fi apoi determinată prin cântărirea catodului. Thomas Edison a folosit voltametre drept contoare de energie electrică. (Un voltametru Hofmann nu pot fi folosit pentru a evalua curentul electric în acest mod, deoarece electrozii de platină sunt prea inerți la placare.)
Un voltametru Hofmann este adesea folosit ca un exemplu de principii stoichiometrice, ca raport de doi la unu dintre volumele de hidrogen și oxigen: gazul produs de aparat ilustrează formula chimică a apei, H2O. Însă acest lucru este adevărat numai dacă gazele oxigen și hidrogen sunt presupuse a fi biatomice. Dacă hidrogenul ar fi monoatomic și oxigenul biatomic, raportul volumelor de gaz ar fi 04:01. Compoziția volumică a gazelor provenite din apă este prezentată în raportul volumelor de hidrogen (H) și oxigen (O). Experimental, această valoare este de 2:1, valoare determinată utilizând voltametre cu apă Hofmann.
Referințe
modificare- von Hofmann, A. W., Introducere în Chimia Modernă: experimental și teoretic; Încorporează Douăsprezece prelegeri ținute la Colegiul Regal de Chimie, Londra. Walton și Maberly, Londra, 1866.