Difluorură de oxigen
| Diflorură de oxigen | |
 | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | anhidrida hipofluoroasă |
| Identificare | |
| Număr CAS | 7783-41-7 |
| PubChem CID | 24547 |
| Informații generale | |
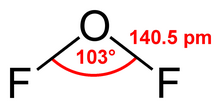
| Formulă chimică | OF2 |
| Aspect | gaz incolor, lichid galben când este condensat |
| Masă molară | 53,9962 g/mol |
| Proprietăți | |
| Densitate | 1,9 g/cm3 (ca lichid, la -145 °C) |
| Punct de topire | −223,8 °C |
| Punct de fierbere | −144,8 °C |
| Solubilitate | 8 mL gazos la 1 L de apă(0 °C) |
| Presiune de vapori | 1 atm[2] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Difluorura de oxigen este un compus binar al fluorului cu oxigenul cu formula chimică OF2. Datorită electronegativității fluorului din diflorura de oxigen, formula chimică a compusului este OF2 și nu F2O, cum ar trebui să fie (oxid de fluor).
Proprietăți
modificareFizice
modificareDifluorura de oxigen este un gaz incolor cu miros caracteristic ce atacă căile respiratorii. Este mai grea decât aerul și are caracter oxidant.
Chimice
modificareReacția cu apa este următoarea:
- 2F2 + 2H2O = 4HF + O2
Obținere
modificareDifluorura de oxigen se obține prin trecerea rapidă a unui curent de fluor (1 l/s) printr-o soluție apoasă de hidroxid de sodiu de concentrație 2% (ce stă într-un vas spălător), după reacția:
- 2F2 + 2NaOH = 2NaF + F2O + H2O
În cultură
modificareÎn romanul științifico-fantastic al lui Robert L. Forward Camelot 30K, difluorura de oxigen era folosită ca solvent biochimic de către ființele ce locuiau în Centura Kuiper din Sistemul Solar.
Bibliografie
modificare- Manual de lucrări practice de chimie anorganică- Monoxidul de fluor, de Raluca Ripan și I. Ceteanu, 1961, pag. 65
- ^ „Difluorură de oxigen”, Oxygen difluoride (în engleză), PubChem, accesat în
- ^ http://www.cdc.gov/niosh/npg/npgd0475.html Lipsește sau este vid:
|title=(ajutor)