Reacție Belousov-Zhabotinsky
O reacție Belousov-Zhabotinsky (adesea notată reacție B-Z)[1] este un tip de reacție chimică oscilantă care poate fi dată ca exemplu clasic de termodinamica de neechilibru, întrucât aceasta este un oscilator chimic non-linear.[1] Elementele comune ale acestor reacții sunt ionul bromură și un acid. Importanța reacțiilor BZ constă în faptul că acestea demonstrează că reacțiile chimice nu sunt neapărat supuse unui echilibru termodinamic (lipsa echilibrului termodinamic se păstrează o perioadă îndelungată de timp și evoluează haotic).[2]

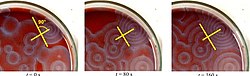
Mecanism de reacție
modificareMecanism acestei reacții este extrem de complex și se crede că implică în jur de 18 etape diferite de reacție; legat de acest subiect au fost publicate multe lucrări științifice.[3][4] Într-un mod similar reacției Briggs-Rauscher, două procese fundamentale au loc, ambele fiind auto-catalitice: procesul A generează brom molecular, responsabil de colorația roșie-brună, iar procesul B consumă bromul format eliberând ioni bromură.[5]
De cele mai multe ori, pentru realizarea acestei reacții chimice se utilizează varianta cu acid malonic (CH2[COOH]2) și bromat de potasiu (KBrO3). Ecuația generală a reacției chimice este:[5]
- 3 CH2(COOH)2 + 4 BrO−
3 → 4 Br− + 9 CO2 + 6 H2O
Reacții chimice
modificarePentru desfășurarea reacției, sunt necesare patru soluții apoase, și anume de bromat de potasiu, acid malonic și un amestec de bromură de potasiu și acid sulfuric concentrat, și de asemenea, este necesar și un indicator redoxometric, adesea feroină (culoarea acestuia se schimbă constant datorită echilibrului dintre forma redusă și forma oxidată). În cazul feroinei, culoarea se modifică de la albastru (corespunzătoare formei cu Fe3+) la roșu (corespunzătoare formei cu Fe2+). În cazul ceriului, indicatorul trece de la galben (Ce4+) la incolor (Ce3+). Reacția nu decurge la nesfârșit, întrucât acidul malonic și bromatul se consumă în mediul de reacție.
În timpul reacției, se desfășoară trei procese diferite (notate A, B și C), fiecare cu câteva reacții chimice separate. Procesul A nu implică utilizarea indicatorului redox. Bromura se consumă și este transformată în acid monobromomalonic. În timpul acestei reacții se formează acidul bromos, care reacționează în continuare:[6]
- Procesul A
Odată cu consumarea unei cantități mari de brom, este favorizat în continuare procesul B, al cărui reacții se desfășoară în prezența indicatorului redox. Într-o primă reacție, acidul bromos acționează ca un autocatalizator, dublând concentrația de acid bromos format în reacție:
Cu cât este mai ridicat nivelul de acid bromos, cu atât acesta trece mai ușor în acid hipobromos, astfel că reacția generală pentru procesul B este:
Pentru ca oscilația să fie posibilă, trebuie să aibă loc o altă reacție prin intermediul căreia să se reformeze ioni bromură. Acesta este procesul C, în care acidul malonic (H2Mal), acidul monobromomalonic (HBrMal), hipobromitul și indicatorul redox reacționează regenerând ionii bromură necesari și formând și acidul tartronic [acid 2-hidroximalonic, HOCH(COOH)2]:
Schemă
modificareVezi și
modificareNote
modificare- ^ a b Dicționar de chimie John Daintith, traducere de Mihaela Rudeanu și Lia Cojocaru; ediția a VI-a, Editura All, 2010, București; pag. 408, ISBN 978-973-684-725-7
- ^ Hudson, J.L.; Mankin, J.C. (). „Chaos in the Belousov–Zhabotinskii reaction”. J. Chem. Phys. 74 (11): 6171–6177. doi:10.1063/1.441007.
- ^ Field, Richard J.; Foersterling, Horst Dieter (). „On the oxybromine chemistry rate constants with cerium ions in the Field-Körös-Noyes mechanism of the Belousov-Zhabotinskii reaction: The equilibrium HBrO2 + BrO3− + H+ → 2 BrO2• + H2O”. The Journal of Physical Chemistry. 90 (21): 5400–7. doi:10.1021/j100412a101.
- ^ Sirimungkala, Atchara; Försterling, Horst-Dieter; Dlask, Vladimir; Field, Richard J. (). „Bromination Reactions Important in the Mechanism of the Belousov−Zhabotinsky System”. The Journal of Physical Chemistry A. 103 (8): 1038–43. Bibcode:1999JPCA..103.1038S. doi:10.1021/jp9825213.
- ^ a b Lister, Ted (). Classic Chemistry Demonstrations (PDF). London: Education Division, The Royal Society of Chemistry. pp. 3–4. ISBN 978-1-870343-38-1. Arhivat din original (PDF) la .
- ^ Richard J. Field, Friedmann W. Schneider: Oszillierende chemische Reaktionen und nichtlineare Dynamik. In: Chemie in unserer Zeit. 22, Nr. 1, 1988, S. 17–29, doi:10.1002/ciuz.19880220104.