Acid citric
| Acid citric | |
 | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | acid citric acid tricarbo-1,2,3-hidroxi-propanoic sare de lămâie E 330 |
| Identificare | |
| Număr CAS | 77-92-9 (anhidru) 5949-29-1(monohidrat) |
| ChEMBL | CHEMBL1261 |
| PubChem CID | 19782904, 88113319 311, 19782904, 88113319 |
| Informații generale | |
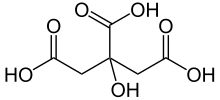
| Formulă chimică | C6H8O7 |
| Aspect | pulbere incoloră |
| Masă molară | 192.123 g·mol-1[1] |
| Proprietăți | |
| Densitate | 1,665 g·cm−3 (18 °C) |
| Starea de agregare | solid |
| Punct de topire | 153 °C |
| Punct de fierbere | la 175 °C se descompune |
| Solubilitate | bună în apă 605 g·l−1 (20 °C insolubil în cloroform |
| Presiune de vapori | 5 · 10−7 Pa (25 °C) |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acidul citric (acid 2 hidroxi-1,2,3 propan tricarboxilic C6H8O7) este un acid tricarboxilic care se prezintă ca o pulbere incoloră, cu un gust acru, ușor solubil în apă. Este cunoscut și sub numele de sare de lămâie.
Istoric
modificareAcidul citric a fost produs pentru prima oară din suc de lămâie în anul 1784 de Karl Wilhelm Scheele. Ea era deja cunoscută în secolul IX de alchimiști, ca de exemplu alchimistul arab „Dschābir ibn Hayyān” care a descoperit acidul citric.
Răspândire în natură
modificareAcidul citric este unul dintre cei mai răspândiți acizi în natură. Astfel se poate întâlni în plante, sau ca produs în urma proceselor metabolice ale glucidelor sau lipidelor (ciclul lui Krebs sau al lui Meyerhof-Parnas) în organismul animal din respirația tisulară sau în timpul sintezei aminoacizilor esențiali. Acidul citric se găsește în sucurile plantelor citrice, mere, pere, vișine, zmeură, coacăze, în conifere, ciuperci, foi de tutun, vin și chiar în lapte.
Rol metabolic
modificareAcidul citric rezultă din condensarea acetilcoenzimei A cu acid oxalilacetic în prima etapă a ciclului Krebs.
Mod de obținere
modificare- Din citrice
Sucul din fructe (lămâie) va fi tratat cu amoniac concentrat și filtrat. Citratul de amoniu obținut este ușor solubil, care tratat cu hidroxid de calciu rezultând citrat de calciu care este greu solubil în apă. Urmează o nouă filtrare a amestecului. Prin tratare cu acid sulfuric (25%) se formează sulfat de calciu insolubil care este din nou eliminat prin filtrare obținându-se acid citric sub formă cristalină.
- Producerea bio-tehnologică
Acest procedeu constă în cultivarea mucegaiului „Aspergillus niger” pe medii cu glucoză în prezența ionului bivalent de Fe2+.
Biochimie
modificareCitratul, baza conjugată a acidului citric, este unul din seriile de compuși implicați în oxidarea fiziologică a grăsimilor, proteinelor, iar carbohidrații pentru dioxidul de carbon și apă. Această serie de reacții chimice este esențială pentru aproape toate reacțiile metabolice, și este sursa a două treimi de energie din alimentele derivate. Seria de reacții este cunoscut sub diferite nume, printre care "ciclul acid citric", "ciclul Krebs" sau "Szent-Györgyi - ciclul Krebs", și "Ciclul TCA". De asemenea, citratul este o componentă esențială a oaselor, contribuind la reglarea mărimii cristalelor de calciu.
Utilizare
modificareAcidul citric este folosit:
- pentru dizolvarea carbonatului de calciu în procesul de curățare a cazanelor sau vaselor de bucătărie, prin încălzirea apei se depune calcar;
- la conservarea în alimentație, fiind folosit la preparea răcoritoarelor fiind numit „E 330”;
- ca peptizator folosit la stabilizarea unor suspensii;
- efect negativ îl are în doze mari, scade pH-ul în alimente crescând însă incidența cariilor dentare;
- alt efect negativ în alimentația sugarilor, favorizează absorbția în sânge a metalelor grele (cadmiu, plumb);
- la reducerea sau împiedicarea coagulării sângelui, de aceea este folosit la conservarea sângelui pentru transfuzii în medicină, în raport de 10 : 1 sânge/citrat de calciu;
- la reducerea coroziunii metalelor nobile;
- citratul de calciu utilizat ca hrană pentru căinii cu deficințe de calciu;
- citratul de magneziu folosit în cazul deficiențelor de magneziu din organism;
- citratele servesc la reglarea pH-ului unor medicamente;
- citratul de sodiu este folosit în construcții la reglarea vitezei de legare a cimentului.
Note
modificare- ^ După G. P. Moss (). IUPAC Commission on Isotopic Abundances and Atomic Weights, ed. „Atomic Weights of the Elements 2015”. Parametru necunoscut
|coautor=ignorat (ajutor) - ^ „Acid citric”, citric acid (în engleză), PubChem, accesat în
Bibliografie
modificare- A. Lehninger, Biochimie vol I-II, Editura Tehnică, București 1987-1992
- V. Ranga; I. Teodorescu Exarcu. Anatomia și fiziologia omului, Editura Medicală, București 1970
Legături externe
modificare- „citric” la DEX online
- Definiție pentru aditivul alimentar „E330” la infocons.ro (denumire și descriere).
- de Bundesinstitut für Risikobewertung – Concentrațiile mari de acid citric măresc incidența cariilor dentare