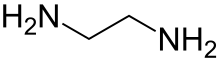
Etilendiamină
| Etilendiamină | |
 | |
 | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 107-15-3 |
| ChEMBL | CHEMBL816 |
| PubChem CID | 3301 |
| Formulă chimică | C₂H₈N₂[1] |
| Masă molară | 60,069 u.a.m.[1] |
| Proprietăți | |
| Densitate | 0,91 g/cm³[2] |
| Punct de topire | 8,3 °C[2] |
| Punct de fierbere | 116,1 °C[2] |
| Presiune de vapori | 11 mm Hg[2] |
| Indice de refracție(nD) | 1,4565[3] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Etilendiamina (IUPAC: etan-1,2-diamină, abreviată en când este ligand) este un compus organic, o diamină cu formula chimică C2H4(NH2)2. Este un lichid incolor cu miros similar de amoniac și prezintă caracter bazic. Este un compus important în sinteza organică, aproximativ 500.000 de tone fiind produse la nivel industrial în anul 1998.[4]
Obținere
modificareEtilendiamina este produsă la nivel industrial în urma reacției dintre 1,2-dicloroetan și amoniac, la o presiune de 180 °C și în mediu apos:[4][5]
În urma acestei reacții se generează acid clorhidric, care formează o sare cu grupele aminice. Amina este eliberată prin reacția cu o bază, precum hidroxid de sodiu, și poate fi separată prin rectificare. Ca produși secundari se formează și dietilentriamina (DETA) și trietilentetramina (TETA).
O altă metodă industrială presupune reacția etanolaminei cu amoniac:[6]
Etilendiamina poate fi purificată prin tratarea cu hidroxid de sodiu, etapă urmată de distilare.[7]
Note
modificare- ^ a b c „Etilendiamină”, ethylenediamine (în engleză), PubChem, accesat în
- ^ a b c d http://www.cdc.gov/niosh/npg/npgd0269.html Lipsește sau este vid:
|title=(ajutor) - ^ CRC Handbook of Chemistry and Physics (97th edition)[*], p. 3-244 Verificați valoarea
|titlelink=(ajutor) - ^ a b Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" în Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. doi:10.1002/14356007.a02_001
- ^ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 245, Wiley VCH
- ^ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 275, Wiley VCH
- ^ Rollinson, Carl L.; Bailar, Jr., John C. (). „Tris(ethylenediamine)chromium(III) Salts”. Inorganic Syntheses. Inorganic Syntheses. 2. pp. 196–200. doi:10.1002/9780470132333.ch60. ISBN 9780470132333.