Oxalat de sodiu
| Oxalat de sodiu | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 62-76-0 |
| ChEMBL | CHEMBL182928 |
| PubChem CID | 517020 6125, 517020 |
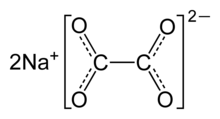
| Formulă chimică | C₂Na₂O₄[1] |
| Masă molară | 133,959 u.a.m.[1] |
| Punct de fierbere | 450 °C |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Oxalatul de sodiu este sarea sodiului cu acidul oxalic și are formula chimică Na2C2O4. Este un solid alb, cristalin, inodor și solubil în apă. Se descompune la o temperatură de 290 °C.[2]
Obținere
modificareOxalatul de sodiu poate fi preparat în urma reacției de neutralizare a acidului oxalic cu o soluție de hidroxid de sodiu în raport molar acid:bază de 1:2. În urma evaporării se obține oxalatul de sodiu anhidru[3] care poate fi uscat prin încălzire între 200 și 250 °C.[2]
Poate fi produs prin reacția sodiului cu dioxid de carbon uscat, la 350°C.
Mai poate fi produs prin încălzirea rapidă de formiat de sodiu la 300-420°C când se produce o descompunere energică cu degajare de hidrogen. Oxalatul de sodiu poate fi apoi caustificat cu lapte de var pentru obținerea de oxalat de calciu care e apoi tratat cu acid sulfuric pentru eliberarea acidului oxalic[4].
Proprietăți
modificareLa o temperatură mai mare de 290 °C, oxalatul de sodiu se descompune de carbonat de sodiu și monoxid de carbon:[2]
- Na
2C
2O
4 → Na
2CO
3 + CO
Permanganometrie
modificareOxalatul de sodiu este utilizat pentru standardizarea soluțiilor de permanganat de potasiu în chimia analitică cantitativă. Amestecul de titrare se aduce la o temperatură mai mare de 60 °C pentru a se asigura reacționarea rapidă a celor doi componenți. Cinetica reacției este una complexă, iar ionii de mangan (II) care se formează catalizează reacția dintre anionul permanganat și acidul oxalic format in situ datorită excesului de acid sulfuric din mediu. Ecuația reacției redox ce are loc în standardizarea permanganometrică este:[5]
- 5 Na2C2O4 + 2 KMnO4 + 8 H2SO4 → K2SO4 + 5 Na2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O
Note
modificare- ^ a b c „Oxalat de sodiu”, Sodium oxalate (în engleză), PubChem, accesat în
- ^ a b c Yoshimori T1, Asano Y, Toriumi Y, Shiota T. (1978) "Investigation on the drying and decomposition of sodium oxalate". Talanta, volume 25, issue 10, pages 603-605. doi:10.1016/0039-9140(78)80158-1
- ^ H. W. Foote and John E. Vance (1933), "The system; sodium iodate, sodium oxalate, water". American Journal of Science, series 5, volume 26, issue 151, pages 16-18. doi:10.2475/ajs.s5-26.151.16
- ^ Nenițescu, ediția a VIII-a (1980), p. 760
- ^ Mcbride, R. S. (). „The standardization of potassium permanganate solution by sodium oxalate”. J. Am. Chem. Soc. 34 (4): 393–416. doi:10.1021/ja02205a009.
Bibliografie
modificare- C. D. Nenițescu, Chimie organică, ediția a VIII-a, vol I, Editura Didactică și Pedagogică, București, 1980