Aldehidă
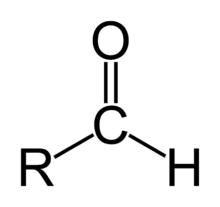
Aldehidele sunt compuși organici care conțin în molecula lor o grupă carbonil, care se leagă de un atom de hidrogen și de un radical (după cum se observă și în imagine). Cea mai simplă aldehidă este formaldehida, formată prin oxidarea metanului. Denumirea de aldehidă provine de la cuvintele alcool dehidrogenat și face referire la una dintre metodele de obținere, anume dehidrogenarea alcoolilor primari.
Nomenclatură
modificareIUPAC
modificareConform regulilor IUPAC, nomenclatura se stabilește astfel:
- stabilirea catenei cu cei mai mulți atomi de carbon.
- Adăugarea sufixului -al la denumirea alcanului respectiv: H-CHO-metanal, CH3-CHO etanal etc.
- În cazul aldehidelor aromatice , acestea se denumesc prin adăugarea denumirii aldehidei la radicalul aromatic fenilmetanal, sau adăugarea denumirii radicalului aldehidic la hidrocarbură formilbenzen (nomenclatură destul de rar utilizată)
Alte nomenclaturi
modificareMai des folosite sunt cele formate din denumirea acidului cu aceeași structură: H-CHO-formaldehidă, C6H5-CHO -benzaldehidă
Sinteza
modificare- Dehidrogenarea sau oxidarea alcoolilor primari
;
- Oxidarea Swern[2] Arhivat în , la Wayback Machine.
Alcooli sunt oxidați la aldehide prin intermediul sulfoxizilor.
- Hidroliza compușilor halogenați
- Adiția apei după regula lui Markovnikov la alchine
- Descompunerea sărurilor de calciu
- Reducerea esterilor
- Ozonoliza alchenelor sau polienelor
;
Proprietăți fizico-chimice
modificareProprietăți fizice
modificareCu excepția formaldehidei, care este un gaz, celelalte aldehide sunt lichide, având un miros caracteristic.Ei pot fi solubili în apă dar numai aldehidele cu 5 atomi de carbon, restul neputând forma legături de hidrogen cu apa.Tot din această cauză ei au puncte de fierbere mai scăzute comparativ cu alcoolii corespunzători. [3] [4] Arhivat în , la Wayback Machine.
Caracterizare spectrală
modificareSpectre UV
modificareGrupa carbonil este un cromofor, datorită celor 2 electroni nepatricipanți aflați în orbitalii ps, mai precis 2ps.Având loc tranziții de tip n→π*(tranziții cu energie mică) maximele de absorbție la nivelul spectrelor UV apar la lungimi de undă λ=270-290nm.Atunci când tranziția electronilor are loc din orbitalii π→π * energiile de absorbție sunt mai mari , la lungimi de undă λ=190-200nm.
Spectre IR
modificareAldehidele(în general compușii carbonilici) manifestă o bandă de absorbție 1700±40cm [5] Arhivat în , la Wayback Machine.[6], bandă care este foarte mult influențată de starea fizică, de (ne)formarea legăturilor de hidrogen.
Proprietăți chimice
modificareDepind în mare măsură de hibridizarea atomilor din grupa carbonilică.Atât atomul de carbon cât și cel de oxigen au aceeași stare de hibridizare sp2, unghiul dintre cei 2 substituenți ai carbonului fiind de 1200
Hibridizarea sp2 mai este înâlnită și la alchene dar spre deosebire de acestea, atomul de O al grupării carbonil are electroni neparticipanți, în orbitali sp2.Dtaorită acestui fapt, precum și a diferenței mari de electronegativitate dintre carbon și oxigen. gruparea C=O are un caracter polar foarte puternic ceea ce îi permite participarea la reacții de adiție a unor compuși polari (apa, compuși organomagnezieni).
Reacții de adiție
modificareSunt comune și aldehidelor și cetonelor.
- Adiția apei:
;
Prin adiția apei are loc formarea compușilor numiți hidrați, compuși ce nu au putuit fi izolați, ci doar puși în evidență prin metode spectrometrice.
- Adiția alcoolilor are loc în mediu acid după un mecanism de substituție nucleofilă de tip 1 SN1, produsul final fiind denumit semiacetal:
;
- Adiția hidrogenului duce la diferiți compuși în funcție de catalizator:
- catalizator Ni Raney, la o temperatură de circa 500C are loc formarea alcoolului corespunzător primar sau secundar (cazul cetonei):
;
- catalizator TiCl3, când se formează alchene (reacția McMurry)
- Adiția hidracizilor HX.
Hidracizii mai ales cel clorhidric și bromhidric se adiționează la grupa carbonil dând naștere la halohidrine, compuși instabili.Aceștia pot reacționa cu alcoolii care se adaugă în mediul de reacție formându-se astfel eteri α halogenați ;
- Adiția acidului cianhidric HCN, duce la formarea de cianhidrine
Reacția are loc după un mecanism de adiție nucleofilă, în cataliză bazică cu regenerarea catalizatorului. ;
- Adiția amoniacului
Produsul poartă denumirea de aduct amoniac-aldehidă,compus instabil care se poate polimeriza. ;
- Adiția bisulfitului de sodiu
Adiția bisulfitului de sodiu duce la formarea de compuși bisulfitici, cristalizați, insolubili în solvenți organici, folosiți pentru izolarea compușilor carbonilici:
;
- Adiția cloroformului
Are loc în prezența KOH, după un mecanism de tip nucleofil:
;
- Adiția compușilor organomagnezieni
;
Reacții de condensare
modificare- Condensare cu aldehidă
Aldehidele pot adiționa o altă moleculăp de aldehidă , in mediu bazic formându-se un compus numit aldol (aldehid-alcool) ;
- Condensare cu hidrocarburi:
- alchene (reacția Prins[7])
Reacția Prins are la bază condensarea alchenelor cu aldehidele, în cataliză acidă, cu formare de 1,3 glicoli sau 1,3 dioxani (acetali ciclici ai formaldehidei)
- Ciclopentadiena Compușii condensării se numesc fulvene