Amoniu cuaternar
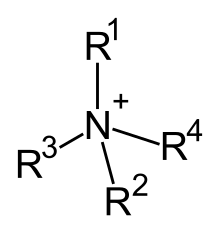
Cationii de amoniu cuaternar sunt ioni poliatomici încărcați pozitiv cu structura chimică NR+
4, unde R este o grupă alchil sau aril.[1] Spre deosebire de ionul de amoniu (NH+
4) și de cationii de amoniu primar, secundar și terțiar, cationii de amoniu cuaternar posedă sarcină permanentă, independentă de pH-ul soluției în care se află. Compușii care conțin acest ion se numesc săruri de amoniu cuaternar sau săruri cuaternare de amoniu, și sunt săruri ai aminelor.
Obținere
modificareCompușii de amoniu cuaternar sunt preparați în urma reacției de alchilare exhaustivă a unei amine terțiare cu un derivat halogenat.[2] Reacția este de obicei cunoscută ca alchilare Hofmann sau reacție de cuaternizare.[3] Reacția poate fi folositoare și pentru obținerea unor compuși în care catenele alchilice sunt de lungimi diferite, cum ar fi de exemplu producerea de surfactanți cationici (una dintre grupele alchilice este de obicei mai lungă).[4]
Un exemplu este sinteza clorurii de banzalconiu, un surfactant cationic, din alchildimetilamină și clorură de benzil:
- CH3(CH2)nN(CH3)2 + ClCH2C6H5 → [CH3(CH2)nN(CH3)2CH2C6H5]+Cl−
Proprietăți
modificareCompușii de amoniu cuaternar sunt inerți, chiar și față de agenți electrofili puternici, oxidanți sau acizi. De asemenea, sunt stabili și față de majoritatea nucleofililor. Datorită acestor proprietăți, munți anioni mai greu de izolat au fost stabilizați sub formă de săruri de amoniu cuaternar, cum este de exemplu cazul pentafluoroxenatului de tetrametilamoniu, ce conține ionul foarte reactiv de pentafluoroxenat (XeF−
5). Permanganații pot fi solubilizați în solvenți organici, sub formă de săruri de tipul NBu+
4.[5][6]
Cationii de amoniu cuaternar ce conțin unități structurale de forma N–C–C–H sunt susceptibile eliminării Hoffman și degradării Emde.
Vezi și
modificareReferințe
modificare- ^ IUPAC, Compendium of Chemical Terminology, Ed. a 2-a („Gold Book”) (1997). Versiune online: (2006-) „quaternary ammonium compounds”.
- ^ W. R. Brasen, C. R. Hauser (). „o-Methylethylbenzyl Alcohol”. Org. Synth. 34: 58. doi:10.15227/orgsyn.034.0058.
- ^ Smith, Michael B.; March, Jerry (), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (ed. 5th), New York, NY: Wiley-Interscience, ISBN 0-471-58589-0
- ^ Kosswig, K. (), „Surfactants”, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a25_747
- ^ Herriott, Arthur W. (). „Purple benzene: Solubilization of anions in organic solvents”. J. Chem. Educ. 54 (4): 229. Bibcode:1977JChEd..54Q.229H. doi:10.1021/ed054p229.1.
- ^ Doheny, Anthony J., Jr.; Ganem, Bruce (). „Purple benzene revisited”. J. Chem. Educ. 57 (4): 308. Bibcode:1980JChEd..57..308D. doi:10.1021/ed057p308.1.