Carboran
| Acest articol (sau secțiunea de mai jos) conține greșeli de ortografie sau de punctuație. Puteți consulta manualul de stil și contribui prin corectarea greșelilor. |
Carboranul este un compus de tip cluster a borului cu carbonul: Face parte din clasa boranilor avînd ca și aceștia structură poliedrică fiind similar clasificați în closo-, nido-, arachno-, hipho-, etc. în funcție de repezentarea unui poliedru complet(closo-) sau a unuia căruia îi lipsesc una (nido-), două (arachno-), sau mai multe vertexuri. Unul dintre cei mai cercetat carboran este un compus extrem de stabil cu simetrie icosaedrică closo-carboranul.[1]
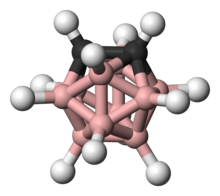
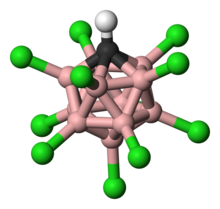
Legendă:
hidrogen − alb,
clor − verde,
bor − roz,
carbon − negru.
Un alt exemplu este cel al C2B10H12 sau o-carboran compus neutru din punct de vedere electric, carboran utilizat în cele mai diverse domenii de la polimeri termorezistenți pînă la domeniul medical. O-carboranul este denumit compus superaromatic deoarece se supune regulii lui Huckel, având o stabilitate termică mare.la fel ca și arenele carboranii suferă reacții de substituție electrofilă.
Un carboran puternic electronegativ este CHB11H12−, utilizat în sinteza superacizilor.
Carboran superacid H(CHB11Cl11)[2] este de circa 1 milion de ori mai puternic decât acidul sulfuric fumans.Această aciditate extrem de puternică este dată de anionul acid CHB11Cl11−, extrem de stabil și care poate fi substituit cu substituenți electronegativi. H(CHB11Cl11) este uncil acid cunoscut care poate protona C60 fulerenă fără a le descompune.[3][4]. De asemenea este unicul anion capabil să formeze o sare stabilă cu benzenul protonat C6H7+.
Dicarbadodecaboran
modificareUnul dintre cei mai intens studiați carborani este C2B10H12, cu pucnt de fierbere 320 C. Este preparat prin reacția dintre acetilenă și decaboran, sau o altă variantă ce utilizează dimetil acetilenedicarboxilat ce dă naștere la C2B10H10(CO2C H3)2, ce poate fi degradat la C2B10H12.[5]
Istoric
modificare1,2-closo-dicarbadodecaboranul (numit mai simplu carboran), a fost simultan sintetizat de către at Olin Corporation și de către Reaction Motors Division of Thiokol Chemical Corporation (U.S. Air Force) and published in 1963.[6][7][8][9][10][11][12][13][14].Derivații decaboranului au arătat o instabilitate termică și o reactivitate mare în prezența aerului și a apei.Totodată grupul 1,2-closo-dodecaboranului a arătat o stabilitate foarte mare iar în sinteze transformarea în compuși subtituiți are loc fără distrugerea complexului de tip cluster, precum și izomerizarea din orto în meta.
Dicarbolide
modificareAnionul dicarbolid cu formula, [B9C2H11]2− formează compuși de tip sandwich cu multe metale a căror ioni au numere de oxidare neobișnuite. Dianionul este un nido- cluster obținut prin degradarea dicarboranului.[15]
- B10C2H12 + 3 CH3OH + KOH → KB9C2H12 + B(OCH3)3 + H2O + H2
Carborin
modificareCarborin, sau 1,2-dehidro-o-carboranul, este un compus instabil derivat al orto-carboranului cu formula B10C2H10 sintetizat pentru prima oară în anul 1990. Atomii de hidrogen de la C2 al o-carboranului lipsesc deoarece ei sunt îndepărtați prin atacul N-butillitiului în mediu de THF, dianionul rezultat reacționează cu bromul formând anionul monobromurat.Compusul este izolobal cu arenele.[16][17][18].
încălzirea mediului de reacție la eliberează 35 °C carborinul, care poate intra mai departe într-o sinteză dien:
cu antracenul (formează un compus de tip tripticen) și furan.
Carborinul reacționează cu alchinele pentru a forma benzocarboranul [19][20], reacție ce se desfășoară după mecanismul de mai sus.O carboranul suferă o deprotonare în prezența n-butillitiu , iar apoi în prezența dicloro-di(trifenilfosfino) nickel formează un complex în care carborinul leagă coordinativ nichelul.Compusul astfel format reacționează cu 3-hexina printr-o reacție de trimerizare formând benzocarborane.
Prin cristalografia în raze X s-a demostrat că legăturile interatomice au valori cuprinse între 164.8 ppm și 133.8 ppm ceea ce demonstrează ca acești compuși nu au caracter aromatic!
Note
modificare- ^ Eluvathingal D. Jemmis (). „Overlap control and stability of polyhedral molecules. Closo-Carboranes”. J. Am. Chem. Soc. 104: 7017–7020. doi:10.1021/ja00389a021.
- ^ Note that the image the acidic proton is not the one bonded to the carborane but that it is the counterion not displayed
- ^ Mark Juhasz, Stephan Hoffmann, Evgenii Stoyanov, Kee-Chan Kim, Christopher A. Reed (). „The Strongest Isolable Acid”. Angewandte Chemie International Edition. 43: 5352–5355. doi:10.1002/anie.200460005.
- ^ Christopher A. Reed (). „Carborane acids. New "strong yet gentle" acids for organic and inorganic chemistry” (PDF). Chem. Commun. 2005: 1669–1677. doi:10.1039/b415425h. Arhivat din original (Full article (reprint)) la . Accesat în .
- ^ Kutal, C. R.; Owen, D. A.; Todd, L. J. (). „Closo-1,2-dicarbadodecaborane(12)”. Inorganic Syntheses. 11: 19–23. doi:10.1002/9780470132425.ch5.
- ^ T. L. Heying, J. W. Ager, S. L. Clark, D. J. Mangold, H. L. Goldstein, M. Hillman, R. J. Polak, and J. W. Szymanski (). „A New Series of Organoboranes. I. Carboranes from the Reaction of Decaborane with Acetylenic Compounds”. Inorganic Chemistry. 2: 1089–1092. doi:10.1021/ic50010a002.
- ^ H. Schroeder, T. L. Heying, J. R. Reiner (). „A New Series of Organoboranes. II. The Chlorination of 1,2-Dicarbaclosododecaborane(12)" Inorganic Chemistry”. Inorganic Chemistry. 2: 1092–1096. doi:10.1021/ic50010a003.
- ^ T. L. Heying, J. W. Ager, S. L. Clark, R. P. Alexander, S. Papetti, J. A. Reid, S. I. Trotz (). „A New Series of Organoboranes. III. Some Reactions of 1,2-Dicarbaclosododecaborane(12) and its Derivatives”. Inorganic Chemistry. 2: 1097–1105. doi:10.1021/ic50010a004. Text " Inorganic Chemistry " ignorat (ajutor)
- ^ S. Papetti, T. L. Heying (). „A New Series of Organoboranes. IV. The Participation of the 1,2-Dicarbaclosododecaborane(12) Nucleus in Some Novel Heteratomic Ring Systems”. Inorg. Chem. 2: 1105–1107. doi:10.1021/ic50010a005.
- ^ M. M. Fein, J. Bobinski, N. Mayes, N. Schwartz, M. S. Cohen (). „Carboranes. I. The Preparation and Chemistry of 1-Isopropenylcarborane and its Derivatives (a New Family of Stable Closoboranes)”. Inorg. Chem. 2: 1111–1115. doi:10.1021/ic50010a007.
- ^ M. M. Fein, D. Grafstein, J. E. Paustian, J. Bobinski, B. M. Lichstein, N. Mayes, N. N. Schwartz, M. S. Cohen (). „Carboranes. II. The Preparation of 1- and 1,2-Substituted Carboranes”. Inorg. Chem. 2: 1115–1119. doi:10.1021/ic50010a008.
- ^ D. Grafstein, J. Bobinski, J. Dvorak, H. Smith, N. Schwartz, M. S. Cohen, M. M. Fein (). „Carboranes. III. Reactions of the Carboranes”. Inorg. Chem. 2: 1120–1125. doi:10.1021/ic50010a009.
- ^ D. Grafstein, J. Bobinski, J. Dvorak, J. E. Paustian, H. F. Smith, S. Karlan, C. Vogel, M. M. Fein (). „Carboranes. IV. Chemistry of Bis-(1-carboranylalkyl) Ethers”. Inorg. Chem. 2: 1125–1128. doi:10.1021/ic50010a010..
- ^ D. Grafstein, J. Dvorak (). „Neocarboranes, a New Family of Stable Organoboranes Isomeric with the Carboranes”. Inorg. Chem. 2: 1128–1133. doi:10.1021/ic50010a011.
- ^ Plešek, J.; Heřmánek, S.; Štíbr, B. Inorganic Syntheses, 1983, volume 22, pages 231-124.
- ^ Henry L. Gingrich, Tirthankar Ghosh, Qiurong Huang, and Maitland Jones (). „1,2-Dehydro-o-carborane”. J. Am. Chem. Soc. 112 (10): 4082–4083. doi:10.1021/ja00166a080.
- ^ E. D. Jemmis and B. Kiran (). „Structure and Bonding in B10X2H10 (X = C and Si). The Kinky Surface of 1,2-Dehydro-o-Disilaborane”. J. Am. Chem. Soc. 119 (19): 4076–4077. doi:10.1021/ja964385q.
- ^ B. Kiran, A. Anoop, E. D. Jemmis (). „Control of Stability through Overlap Matching: closo-Carboranes and closo-Silaboranes”. J. Am. Chem. Soc. 124: 4402–4407. doi:10.1021/ja016843n.
- ^ Liang Deng, Hoi-Shan Chan, and Zuowei Xie (). „Nickel-Mediated Regioselective [2 + 2 + 2] Cycloaddition of Carboryne with Alkynes”. J. Am. Chem. Soc. 128 (24): 7728–7729. doi:10.1021/ja061605j.
- ^ Eluvathingal D Jemmis and Anakuthil Anoop (). „Theoretical Study of the Insertion Reactions of Benzyne- and Carboryne- Ni Complexes” (PDF). MHPCC Application Briefs: 51. Arhivat din original (PDF) la . Accesat în .
