Nitrozamină
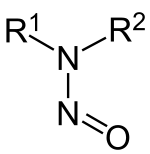
Nitrozaminele alcătuiesc un grup de compuși organici care au formula structurală generală R1N(–R2)–N=O, ceea ce înseamnă că în structura lor se întâlnește o grupă nitrozo legată direct de o grupă funțională amină. Majoritatea nitrozaminelor sunt carcinogene, și sunt componente ale fumului de țigară.[1] Un exemplu este dimetilnitrozamina, (CH3)2-N–N=O
Obținere
modificareÎn mediu de reacție acid, ionul azotit (nitrit) eliberează acid azotos (HNO2), care se poate protona, ceea ce conduce în final la formarea unui cation nitrozoniu N≡O+ și a unei molecule de apă:
- H
2NO+
2 → H2O + NO+
Cationul nitrozoniu, având sarcină pozitivă, este o specie electrofilă, așadar poate reacționa cu o amină pentru a produce nitrozamina corespunzătoare:[2]
- NO+ + R1-NH-R2 → R1-N(-R2)-N=O + H+
Proprietăți fizico-chimice
modificareModalitatea în care sunt substituiți radicalii R1 și R2 face să fie diferențe între nitrozamine în ceea ce privește proprietățile fizico-chimice. La temperatura obișnuită, nitrozaminele se prezintă sub formă lichidă, în cazul dimetilnitrozaminei sau sub formă solidă, în cazul dipropilnitrozaminei.[3] Dialchilnitrozaminele sunt miscibile în apă dar și în numeroși solvenți organici (eter, alcool, cloroform, diclormetan și hexan), temperatura de fierbere este cuprinsă între 150–220°C, având o culoare galbenă sau verzuie-gălbuie.[3]
Majoritatea nitrozaminelor se descompun relativ ușor la UV, rezultând amine secundare și acidul nitros.[3] Nitrozaminele, datorită structurii lor chimice, pot participa la reacții chimice cum ar fi: hidroliza, reducerea, absorbție în UV la 245 și 330 nm.[3]
Vezi și
modificareReferințe
modificare- ^ Dicționar de chimie John Daintith, traducere de Mihaela Rudeanu și Lia Cojocaru; ediția a VI-a, Editura All, 2010, București; pag. 337, ISBN 978-973-684-725-7
- ^ Vogel, A. I. (). Practical Organic Chemistry (ed. 3rd). Impression. p. 1074.
- ^ a b c d Monica Macovei. „Nitrozamine”. p. 3. Arhivat din original la . Accesat în .