Trioxid de molibden
| Trioxid de molibden | |
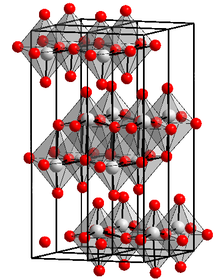 __ Mo6+ __ O2- Structura cristalină a trioxidului de molibden | |
 | |
| Nume IUPAC | Trioxid de molibden |
|---|---|
| Alte denumiri | Anhidridă molibdică Trioxid molibdic Oxid de molibden (VI) |
| Identificare | |
| Număr CAS | 1313-27-5 |
| PubChem CID | 14802 |
| Informații generale | |
| Formulă chimică | MoO3 |
| Aspect | solid galben sau albastru |
| Masă molară | 143,94 g/mol |
| Proprietăți | |
| Densitate | 4,69 g/cm3, solid |
| Starea de agregare | solidă |
| Punct de topire | 795 °C |
| Punct de fierbere | 1 155 °C, sublimă |
| Structură cristalină | Sistem cristalin ortorombic |
| Pericol | |
| Fraze R | R40, R36/37 |
| Fraze S | (S2), S22, S36/37 |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Trioxidul de molibden este un compus anorganic cu formula MoO3. Molecula conține pe lângă cei trei atomi de oxigen și un atom de molibden în starea de oxidare +6. Are câteva utilizări, cele mai importante fiind în reacțiile de oxidare (unde participă ca și catalizator) și ca materie primă în producerea de molibden metalic. În natură, se găsește sub forma unui mineral rar, denumit molibdit.
Obținere și reacții
modificareMoO3 este produs la nivel industrial prin arderea disulfurii de molibden, principalul minereu de molibden:
- 2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
Sinteza din laborator implică acidificarea soluțiilor apoase de molibdat de sodiu cu acid percloric: [1]
- Na2MoO4 + H2O + 2 HClO4 → MoO3(H2O)2 + 2 NaClO4
Dihidratul pierde apa de cristalizare repede pentru a da monohidratul. Ambii compuși sunt galbeni.
Utilizări
modificareTrioxidul de molibden este utilizat în producerea de molibden metalic, element care este folosit ca aditiv în oțel și în aliaje rezistente la coroziune. Reacția propriu-zisă implică tratarea trioxidului cu hidrogen la temperaturi ridicate:
- MoO3 + 3 H2 → Mo + 3 H2O
Este de asemenea și un catalizator component folosit la producerea industrială a acrilonitrilului, prin oxidarea propenei cu amoniac.
Referințe
modificare- ^ Heynes, J. B. B.; Cruywagen, J. J. (). Yellow Molybdenum(VI) Oxide Dihydrate Inorganic Syntheses. 24. p. 191. doi:10.1002/9780470132555.ch56. ISBN 0-471-83441-6.


