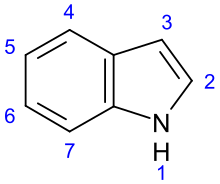
Indol
| Indol | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 120-72-9 |
| ChEMBL | CHEMBL15844 |
| PubChem CID | 798 |
| Formulă chimică | C₈H₇N[1] |
| Masă molară | 117,058 u.a.m.[2] |
| Proprietăți | |
| Densitate | 1,22 g/cm³[3] |
| Punct de topire | 52,3 °C[3] |
| Punct de fierbere | 254 °C[3] |
| Solubilitate | 1,87 gram per kilogram of solventi[4] |
| Presiune de vapori | 100 de kilopascali[5] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Benzopirolul sau indolul este un compus organic heterociclic, fiind format din 2 nuclee:unul aromatic condensat cu un nucleu pirolic. Se găsește în fracția de gudroane distilată la temperaturi de 220-2600C. De asemenea a mai fost identificat în uleiurile volatile extrase din florile de portocal sau iasomie. Denumirea sa este dată de combinația dintre indigo și oleum, datorită faptului că a fost izolat prin tratarea indigoului cu amestec oleum (SO3 și H2SO4)

Sinteza indolului
modificareSinteza Nenițescu
modificareAre la bază o reacție de condensare intre benzochinonă și esteri ai acidului β-aminocrotonic.
Sinteza Bischler-Möhlau
modificareMecanismul reacției este extrem de complex:
- Reacția dintre αbrom acetofenonona cu 2 molecule de anilină pentru a forma intermediarul 4.
- Datorită inducției electrofile a grupării anilinei, are loc o deplasare electronică, ceea ce favorizează o ciclizare internă cu formarea compusului 5
- Compusul 5 suferă imediat o reacție de aromatizare și tautomerie pentru a forma indolul substituit.
Sinteza Leimgruber Batcho
modificarePatentată în 1976, metoda este foarte utilizată în sintezele farmaceutice ale substanțelor cu nucleu indolic.
Sinteza Fischer
modificareReacția constă în încălzirea în prezența ZnCl2, a fenilhidrazonelor aldehidelor sau cetonelor la circa 2000C.Mecanismul [1], propus de Robinson este unul complex, care implică o izomerizare urmată imediat de o transpoziție. Mecanismul propus de Robinson a fost confirmat de folosirea fenilhidrazinei marcate cu N15[2] Arhivat în , la Wayback Machine..
Sinteza Reissert
modificare.
Reacția se desfășoară pe parcursul a mai multor etape:
- Condensarea o-nitrotoluenului 1 cu dietiloxalatul 2 pentru a forma etil-onitrofenilpurivatul 3.
- Ciclizarea reductivă a etil -onitrofenilpiruvatului cu Zn/CH3COOH, formîndu-se acidul 2-indol carboxilic.
- Acidul 2-indol carboxilic poate suferi o decarboxilare prin încălzire, formînd indolul 5.
Sinteza Gassman
modificareSinteza Gassman are la bază un mecanism care poate fi structurat astfel: Primul pas îl constituie oxidarea anilinei cu terț-butil hipoclorit (tBuOCl) pentru formarea cloraminei 2
Pasul 2 îl constituie adiția cetonei, reacție ce are loc la o temperatură de -78 0C, formîndu-se ionul sulfoniu 3.
Pasul 3 îl constituie adiția unei baze (trietilamina). La temperatura camerei aceasta va deprotona ionul sulfoniu transformîndu-l înntr-un compus numit sulfon ilidă (o moleculă neutră din punct de vedere electric , dar care are sarcini electrice opuse la 2 atomi alăturați); sulfon ilida suferă o rearanjare de tip sigmatropic pentru a forma cetona 5.Aceasta formează prin deshidratare 3tiometilindol, compus care prin tratare cu Ni Raney elimină ionul de S, formînd astfel 3-H-indol.
Sinteza Hemetsberger Knittel
modificare.
Sinteza Hemetsberger are la bază descompunerea termică a esterului acidului 3-aril-2-azido-propenoic în esterul acidului 2 indol carboxilic.Mecanismul reacției este necunoscut.
Sinteza Larock
modificareCondensarea o-iodanilinei cu o alchină disubstitută, are loc într-un exces de alchină, în prezența fie a carbonatului de potasiu fie a acetatului de potasiu, în amestec egal cu clorură de litiu. Metoda are avantajul că permite grefarea a numeroase grupări funcționale atît pe nucleul anilinei cît și la nivelul alchinei. Stereochimic, gruparea R cea mai voluminoasă ocupă în final poziția 2 (R2).
Sinteza Madelung
modificarePusă la punct în anul 1912 de către Walter Madelung care încălzește derivații acetilați ai o toluidinei cu etoxid de sodiu la 400 0C, pe parcursul anilor ea mai suferă modificări: Verley 1924(catalizator amidura de sodiu), Tyson 1941 (catalizator terțbutoxidul de potasiu).
Proprietăți chimice
modificareInelul pirolic are o reactivitate mult mai mare față de nucleul benzenic, acest fapt datorîndu-se electronilor neparticipanți ai atomului de azot, electroni neparticipanți care sunt delocalizați. Conform valorii pKa=3,6 acizii tari de tipul acidului clorhidric pot protona acest atom de N din nucleul indolic.
Substituția nucleului indolic
modificareLa indol, spre deosebire de pirol, poziția cea mai reactivă este poziția 3, de 1013ori mai reactivă fața de benzen.În sprijinul acestei teorii eset reacția Vilsmeyer-Haack[4]
.
Dacă poziția 3 este ocupată, substituția poate avea loc și în poziția 2, sau 1, iar atunci când aceste poziții sunt ocupate substituția poate avea loc și pe nucleul benzenic. Această comportare poate fi explicată de un efect de conjugare, efect care este pus în evidență de structurile bipolare.
. .
Reacția Mannich
modificareÎn prezența formaldehidei și a dimetilaminei, indolul suferă o reacție Mannich, produsul final fiind gramina, un tip de alcaloid, care este folosită în reacția de sinteză a triptofanului.
Compuși organometalici
modificareDatorită prezenței atomului de hidrogen de la N, acesta poate fi cedat în reacțiile cu metalele alcaline și cu compușii organomagnezieni (compuși Grignard), la fel ca și pirolul. Explicația ar sta în valoarea pKa a protonului din legătura cu azotul. Această valoare este de 21 în DMSO, deci bazele tari de tipul hidrurii de sodiu sau butil-litiul și un mediu de reacție anhidru sunt necesare pentru deprotonare.Sarea anionului indol poate reacționa pe 2 căi:
- sărurile de potasiu sau de sodiu au tendința de atac electrofil asupra ionului de azot
- compușii Grignard, compușii de tip covalent (combinațiile complexe ale zincului), au tendința de atac asupra poziției 3.
Pentru același motiv solvenții aprotici de tipul DMF(dimetilformamida( și DMSO (dimetilsulfoxid)sunt folosiți ca mediu de reacție pentru prima cale , datorită favorizării atacului la atomul de N, în timp ce solvenții nepolari de tipul toluenului favorizează atacul la C3
Oxidarea indolului
modificareIndolul este relativ ușor oxidat în natură.oxidanți simpli de tipul N-bromosuccinimida oxidează selectiv indolul (1) la oxindol (4 și 5).
Reacții dien
modificareUtilizare
modificareEste de obicei folosit în parfumerie, pentru accentuarea anumitor uleiuri volatile. Nucleul indolic est întîlnit în:
Note
modificare- ^ a b „Benzopirol”, indole (în engleză), PubChem, accesat în
- ^ „Benzopirol”, indole (în engleză), PubChem, accesat în
- ^ a b c CRC Handbook of Chemistry and Physics (97th edition)[*], p. 3-320 Verificați valoarea
|titlelink=(ajutor) - ^ CRC Handbook of Chemistry and Physics (97th edition)[*], p. 5-154 Verificați valoarea
|titlelink=(ajutor) - ^ CRC Handbook of Chemistry and Physics (97th edition)[*], p. 6-112 Verificați valoarea
|titlelink=(ajutor)