Antibiotic
| Acest articol este nominalizat pentru primirea statutului de articol de calitate. Pentru aceasta conținutul și forma articolului trebuie să se ridice la cele mai înalte standarde, precizate printr-o serie de criterii. Dacă subiectul articolului vă este familiar, vă invităm să evaluați calitatea expunerii și |
| Antibiotic | |
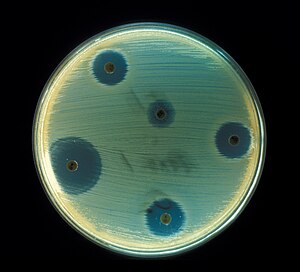 Antibiogramă pentru Staphylococcus aureus, realizată prin metoda difuzimetrică Kirby-Bauer cu scopul de a determina sensibilitatea bacteriei.[1] | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri sau sinonime | Agenți antibacterieni Chimioterapice antibacteriene |
| Identificare | |
| Cod ATC | J01 (Antibacteriene de uz sistemic)[2] |
| Date clinice | |
| Utilizare | Tratamentul infecțiilor bacteriene[3] Profilaxia infecțiilor bacteriene |
| Date farmacocinetice | |
| Țintă biologică | Perete celular bacterian Membrană bacteriană Acizi nucleici Proteine bacteriene Vezi text |
| Modifică date / text | |
Antibioticele (cunoscute și ca antibacteriene, greacă ἀντί- contra, βίος- viață)[4][5] alcătuiesc o clasă de medicamente, produse de microorganisme sau obținute pe cale sintetică sau semisintetică, fiind cele mai importante substanțe medicamentoase implicate în tratamentul și în profilaxia infecțiilor bacteriene de diverse tipuri.[3][6]
Antibioticele sunt utilizate în medicina umană și veterinară, însă au o mare utilitate și în agricultură.[7] În mod normal, ele prezintă toxicitate doar pentru microorganismele cauzatoare ale infecțiilor, fără să afecteze organismul uman sau animal,[8] dar în anumite cazuri acestea pot induce reacții adverse, cea mai frecventă fiind afectarea florei intestinale normale.[9] Din punctul de vedere al acțiunii, antibioticele pot face parte din două clase, ele manifestându-și efectul bacteriostatic (prin oprirea creșterii bacteriei) sau bactericid (prin distrugerea acesteia), însă există și exemple care prezintă ambele mecanisme.[10] Există mai multe criterii conform cărora se mai poate realiza clasificarea antibioticelor, de exemplu structura chimică sau activitatea lor asupra bacteriilor.[11] Un număr limitat de antibiotice posedă, de asemenea, și o activitate antiprotozoarică (cum este, de exemplu, metronidazolul).[12][13]
Din punct de vedere istoric, termenul de antibiotic face referire doar la agenții antibacterieni secretați de către microorganisme, cu scopul de a afecta alte microorganisme și de a oferi protecția față de acestea, și a fost utilizat pentru prima dată în anul 1942.[14] În prezent, definiția s-a extins și la acele substanțe medicamentoase antimicrobiene de origine sintetică, denumite chimioterapice antimicrobiene, precum sunt chinolonele, sulfamidele și nitrofuranii.[14][15][16] Primul antibiotic natural, penicilina, a fost descoperit de către Alexander Fleming, iar această descoperire a permis o dezvoltare impresionantă în ceea ce privește tratamentul infecțiilor bacteriene.[17] Au fost descoperite și sintetizate foarte multe molecule noi de antibiotice de-a lungul ultimul secol, însă în ziua de astăzi eficacitatea antibioterapiei se află sub semnul întrebării datorită unor probleme legate de utilizarea acestora, precum este bine-cunoscuta rezistența la antibiotice.[18]
Scopul antibioterapiei și implicit succesul terapeutic este reprezentat de eliminarea completă a microorganismului patogen din organism. Pentru realizarea acestui fapt, este necesară alegerea unei posologii care asigură o concentrație necesară de antibiotic în focarul infecțios, superioară concentrației minime la care creșterea microorganismului este inhibată.[19] De asemenea, este neapărată alegerea unei căi de administrare pentru un antibiotic, având în vedere starea fiecărui pacient în parte.[20] Fenomenul automedicației este în prezent o problemă gravă în sistemul de sănătate publică, întrucât o alegere neadecvată a unui antibiotic și un ritm de administrare necorespunzător poate avea ca urmare generarea unor tulpini bacteriene rezistente.[21] Antibioticele nu sunt eficiente asupra virusurilor, astfel că virozele sunt tratabile doar cu medicamente antivirale.[22]
Antibioticele sunt obținute la nivel industrial fie prin intermediul microorganismelor (adesea modificate pentru a crește randamentul de producție), fie prin sinteză chimică.[23] Necesitatea obținerii unor noi antibiotice mai bune a dus la cercetări suplimentare, iar un exemplu de alternativă la terapia cu antibiotice este utilizarea virusurilor capabile să distrugă bacteriile, acestea fiind denumite bacteriofagi.[24] Deoarece unele specii patogene au dezvoltat rezistență, pentru identificarea corectă și tratarea infecțiilor este necesară realizarea unei antibiograme, o metodă care indică sensibilitatea speciilor față de un anumit antibiotic.[1]
Istoric
modificareÎn ciuda faptului că medicamentele antibiotice cu spectru larg, care sunt utilizate în mod curent în tratamentul infecțiilor grave (precum tuberculoza și lepra) au fost identificate abia în secolul al XX-lea, unele dintre primele încercări de contracarare ale infecțiilor bacteriene au avut loc acum mai bine de 2500 de ani în China.[25] Se știa încă din acele vremuri că prin presarea pe o plagă a unei bucăți de pâine mucegăite, sau prin utilizarea de lapte fermentat sau de miere, se poate evita instalarea unor infecții.[26][27][28][29]
Multe culturi antice, incluzând Egiptul Antic și Grecia Antică, utilizau mucegaiurile și unele surse vegetale pentru tratarea infecțiilor, datorită proprietăților lor antiseptice. Acest fenomen de inhibare a creșterii unor microorganisme prin asocierea de microorganisme antagoniste a primit denumirea de antibioză.[30][31] Prima descriere referitoare la acest principiu a fost realizată în anul 1877, când Louis Pasteur și Robert Koch au observat faptul că un bacil din aer producea inhibarea creșterii bacteriei Bacillus anthracis (bacilul cărbunos).[32][30]
Sinteza chimică a coloranților antimicrobieni
modificarePrima substanță antibacteriană care poate fi considerată ca antibiotic cu spectru restrâns a fost descoperită de către medicul german Paul Ehrlich (1854-1915). Acesta a observat faptul că unii coloranți prezintă afinități tinctoriale față de celulele umane, animale și bacteriene, iar altele nu, ceea ce a condus la ideea că unii coloranți sintetici ar putea să se lege selectiv de celula bacteriană, distrugând-o, dar fără să producă o afectare semnificativă la om. Astfel, Ehrlich a dezvoltat în anul 1907 primul colorant cu potențial terapeutic antimicrobian, pe care l-a denumit salvarsan sau arsfenamină, după foarte multe încercări eșuate.[11][33][34][35] Acest derivat de arsen a devenit imediat frecvent utilizat în tratamentul sifilisului, boală care era foarte răspândită la acea vreme, și a tripanosomiazei africane.[17][36][37]
În anul 1932, Gerhard Domagk și echipa sa de cercetare de la Bayer Laboratories au sintetizat prima sulfamidă, prontozilul roșu, ceea ce a deschis calea către dezvoltarea unei clase foarte numeroase de substanțe antibacteriene.[35][38][39][40][41] Pentru descoperirea sa, i-a fost acordat Premiul Nobel pentru Fiziologie sau Medicină în anul 1939.[42]
Penicilina și antibioticele naturale
modificareObservații cu privire la puterea inhibitorie a unor microorganisme asupra creșterii altor microorganisme au fost raportate încă de la sfârșitul secolului al XIX-lea. Conceptul de antibioză a dus astfel la curiozitatea legată de existența unor compuși antibacterieni în natură.[43] Astfel, multe cercetări în acest domeniu au început să fie publicate. În anul 1874, William Roberts a notat faptul că în culturile de Penicillium glaucum, un mucegai utilizat la fabricarea unor sorturi de brânză, nu există contaminare bacteriană.[44] În anul 1876, John Tyndall a adus contribuții suplimentare legate de acest subiect.[45] În anul 1895, Vincenzo Tiberio a publicat rezultate referitoare la capacitatea antibacteriană a unor extracte de mucegaiuri.[46]
În anul 1897, doctorandul Ernest Duchesne a prezentat lucrarea de dizertație „Contribution à l'étude de la concurrence vitale chez les micro-organismes: antagonisme entre les moisissures et les microbes” (Contribuție la studiul competiției vitale la micro-organime: antagonism dintre mucegaiuri și microbi),[47] prima lucrare care ia în considerare potențialul terapeutic al mucegaiurilor pe baza activității antimicrobiene. În teza sa, Duchesne propune ideea că ar exista o luptă continuă pentru supraviețuire între bacterii și mucegaiuri, observând că E. coli a fost eliminată de către Penicillium glaucum când au fost cultivate pe aceeași cultură. De asemenea, a observat că animalele de laborator la care s-au inoculat doze letale de bacil tifoid împreună cu Penicillium glaucum nu au dezvoltat infecție cu tiofos. Totuși, nevoia de a se alătura în armată a întrerupt studiile lui Duchesne.[48] În mod paradoxal, Duchesne a murit de tuberculoză, o boală infecțioasă care în prezent beneficiază de tratament antibiotic.[48]
Primul compus descoperit care este considerat ca fiind un antibiotic adevărat este penicilina. Descoperirea epocală a fost realizată de către Alexander Fleming, care a făcut în anul 1928 observația că secreția mucegaiului verde Penicillium notatum (care a contaminat în mod întâmplător culturile, datorită unei ferestre lăsate deschise) are capacitatea de a distruge colonia de bacterii cultivată.[17][49][50] Fleming cercetase anterior proprietățile antibacteriene ale lizozimului și astfel a putut interpreta corect faptul că, prin dezvoltare, organismul fungic a secretat un compus cu putere de inhibiție de creștere asupra bacteriei Staphylococcus aureus. Deși nu a putut realiza izolarea acestuia fără ajutorul chimiștilor, Fleming a publicat rezultatele în literatura de specialitate, iar pe baza denumiri genului Penicillium a oferit compusului numele de penicilină.[51][52][53]
Ernst Chain și Howard Walter Florey au fost savanții care au continuat cercetările lui Fleming și au reușit într-un final să obțină penicilina într-o formă purificată, însă utilizarea acesteia nu a fost disponibilă la scară largă decât după 1945. Structura chimică a penicilinei a fost propusă de către Abraham în 1942[54] și a fost ulterior confirmată de către Dorothy Crowfoot Hodgkin în 1945.[55]
Cecil George a relizat, în anul 1930, primele observații clinice ale terapiei cu penicilină, la pacienții nou-născuți bolnavi de conjunctivită.[56] Chain și Florey au permis, prin studiile intense realizate, acceptarea pencilinei ca agent terapeutic, dar doar în anii 1940, când au început să apară primele înregistrările ale unor beneficii terapeutice.[38] Pentru munca depusă în dezvoltarea penicilinei, Fleming, Chain și Paine au primit Premiul Nobel pentru Medicină în anul 1945.[57][58]
De asemenea, René Dubos a izolat, în 1939, tirotricina (formată din 20% gramicidină și 80% tirocidină), primul antibiotic care a fost testat clinic și unul dintre primele care au fost fabricate la nivel industrial. Aceste descoperiri au fost foarte importante, întrucât au readus la lumină interesul pentru penicilină și au lansat practic „epoca de aur a antibioticelor”.[59] Datorită necesității imperioase de a trata multitudinea de răni infectate cauzate în timpul celui de-al Doilea Război Mondial, au fost investite foarte multe resurse în încercarea de a investiga proprietățile penicilinei și de a o purifica, astfel că în 1940 acest lucru a fost relizat în final.[59] Antibioticele au început să fie frecvent utilizate începând cu anul 1943, când a debutat producția la nivel industrial a penicilinelor în Statele Unite, Regatul Unit, Australia și în alte state.[17]
Restul secolului al XX-lea și secolul al XXI-lea
modificareDezvoltarea și amploarea descoperirii și producției de antibiotice din secolul al XX-lea a început să fie cunoscută sub numele de „epoca de aur a antibioticelor”,[60] o perioadă în care a fost descoperită o multitudine de antibiotice: streptomicina, bacitracina, cloramfenicolul, eritromicina, rifampicina, etc. Perioada 1940 - 1970 este caracterizată de o așa-numită „explozie” a descoperirilor de antibiotice.[38] După popularizarea penicilinei, au început să apară noi clase de antibiotice care au la bază nucleul beta-lactamic, compuși care au fost grupați sub denumirea de antibiotice beta-lactamice. Noile peniciline sintetizate au fost: meticilina, oxacilina, ampicilina și carbenicilina.[61] Cefalosporinele au început să fie dezvoltate după descoperirea cefalosporinei C în 1945, din specia de ciupercă Cephalosporium.[62] Descoperirea streptomicinei din anul 1944 a permis studiul unui număr mare de compuși sintetizați de speciile din genul Streptomyces, ducând la descoperirea de neomicină (1949), kanamicină (anii 1950) și gentamicină (1963).[61] John Ehrlich a reușit să izoleze cloramfenicolul, un compus important, din Streptomyces venezuelae.[63] Au fost caracterizate și primele tetracicline: aureomicina (clortetraciclina, 1948), izolată din Streptomyces aureofaciens,[64] și teramicina (oxitetraciclina, 1950), izolată din Streptomyces rimosus.[65]
Descoperirea macrolidelor a debutat cu eritromicina (iloticină), care a fost izolată din Streptomyces erythreus în 1952.[66] Pentru a evita instabilitatea acesteia în mediu acid, au fost dezvoltați compuși semisintetici, precum claritromicina și azitromicina,[17] iar ulterior a fost dezvoltată telitromicina, o ketolidă.[67] Au urmat glicopeptidele, cu primul reprezentat vancomicina, izolată din Amycolatopsis orientalis în 1955,[68] iar apoi teicoplanina, izolată din Actinoplanes teichomyceticus în 1984.[69] Streptograminele, de asemenea izolate din streptomicete din sol, au fost menționate pentru prima dată în literatură în 1953.[70] Prima lincosamidă, denumită lincomicină, a fost caracterizată în anii 1960 și a fost izolată din Streptomyces lincolnensis,[71][72] iar derivatul semisintetic clorurat al acesteia, clindamicina, a fost descris în anul 1969.[73] Rifamicinele au fost obținute atât prin izolare, cât și prin sinteză chimică: rifampicina a fost descoperită și izolată din Streptomyces mediterranei în 1957,[74] iar apoi au fost obținute rifabutina și rifapentina.
Dezvoltarea clasei chinolonelor și a fluorochinolonelor a avut un impact puternic asupra tratamentului antiinfecțios, acestea inhibând unele enzime necesare în replicarea ADN-ului bacterian (ADN-giraza, topoizomeraza IV).[75] Primul reprezentant, acidul nalidixic, a fost descoperit întâmplător în 1962 în timpul încercării de a sintetiza derivați de clorochină.[76][77] A urmat descoperirea în 1987 a ciprofloxacinei, o moleculă cu spectru antimicrobian îmbunătățit, ceea ce a permis dezvoltarea ulterioară a peste 10 000 de molecule de chinolone.[17][78] Dintre aceștia, doar 20 au început să fie comercializați cu succes.[77] O singură altă clasă capabilă să inhibe giraza bacteriană a fost introdusă, aminocumarinele, cu principalul reprezentant novobiocina.[79][80]
Moleculele dezvoltate în ultimele decenii au ca scop îmbunătățirea spectrului de activitate și eliminarea rezistenței unor specii, precum Pseudomonas aeruginosa. În 1995 a fost introdusă o asociere cu spectru foarte larg de acțiune, denumită piperacilină/tazobactam.[17][81] Au urmat dezvoltările cefalosporinelor de generația a 5-a, cu ceftobiprol (2002) și ceftarolină (2005), care prezintă avantajul activității pe stafilococ auriu meticilino-rezistent (MRSA).[17][82][83] Au fost dezvoltate și unele glicopeptide derivate din vechile molecule, precum: telavancina, dalbavancina și oritavancina.[84]
Un caz interesant este cel al clasei oxazolidinonelor, care a fost menționată prima dată în 1978 având ca indicație utilizarea împotriva patogenilor la plante. Reprezentanții au fost introduși în studii clinice la om, iar primul reprezentant, linezolidul, a fost aprobat pentru uz uman în Statele Unite, abia în anul 2000.[85] O oxazolidinonă de nouă generație, tedizolid, prezintă activitate pe MRSA.[84] Printre cele mai noi antibiotice aprobate în terapie se numără daptomicina, tigeciclina, retapamulina, doripenemul,[86] plazomicina, omdaciclina, eravaciclina, iclaprimul, lefamulina, cefiderocolul, dar și unele asocieri, precum ceftazidimă/avibactam și meropenem/vaborbactam.[87][88]
Pe toată durata secolului al XX-lea, numărul de substanțe antibiotice introduse în terapie a crescut semnificativ, astfel că în perioada 1935 - 1968, 12 noi clase de antibiotice au fost introduse. Totuși, numărul a scăzut drastic, iar între 1969 și 2003 doar două noi clase au fost descoperite.[89] După finalizarea „epocii de aur” a antibioticelor, numărul foarte mare de agenți introduși a dus la utilizarea irațională a acestora în multe domenii, precum medical, veterinar, în industria alimentară și în agricultură, ceea ce a condus la apariția fenomenului sever de rezistență la antibiotice. Prezența antibioticelor în mediul înconjurător creează o presiune asupra bacteriilor patogene de a dezvolta rezistență și distruge bacteriile folositoare.[90] Unele studii propun ca singură metodă de reducere a rezistenței la antibacteriene eliminarea presiunii de selecție asupra bacteriilor patogene.[91]
Deși descoperirea de noi antibiotice a scăzut semnificativ, se pare că produșii naturali încă ar juca un rol important în procesul de descoperire și de dezvoltare al acestor agenți terapeutici.[92] În prezent, există pericolul dezvoltării continue de rezistență la antibiotice de către bacteriile patogene, fapt îngrijorător în special pentru speciile din „grupul ESKAPE”.[93] Nevoia de noi clase de antibiotice sau de noi compuși cu proprietăți farmacologice superioare este în creștere, pe măsură ce medicamentele vechi sunt retrase din uz datorită ineficienței lor în fața tulpinilor de patogene multi-rezistente.[17]
Mecanism de acțiune
modificareDatorită diversității foarte mari în ceea ce privește antibioticele, există o multitudine de mecanisme de acțiune prin care acestea își manifestă efectul de neutralizare sau de toxicitate asupra organismelor bacteriene.[95] Obiectivul unei molecule de antibiotic este de a ajunge la suprafața sau în interiorul celulei bacteriane și de a ținti selectiv anumite structuri moleculare sau biologice din componența acestora, lăsând neafectate celulele gazdei umane sau animale. În acest caz, după cum se poate observa și în diagrama din partea dreaptă, antibioticele pot acționa la nivelul peretelui celular, membranei celulare, acizilor nucleici, proteinelor sau a ribozomilor bacterieni.[94]
De asemenea, prin mecanismul pe care îl prezintă, antibioticele pot face parte din două clase mari, astfel că ele pot avea efect bacteriostatic (inhibând creșterea microorganismelor, dar fără să le distrugă) sau bactericid (provocând moartea celulelor bacteriene), însă există exemple de antibiotice care produc ambele efecte.[10][96]
Peretele celular
modificareUn număr relativ mare de antibiotice își manifestă efectul prin blocarea sintezei, organizării sau formării finale a peretelui celular, în special în punctele de legare ale peptidoglicanului (care este componentul principal al acestuia), dar nu interferă deloc cu alte componente intracelulare.[97] În urma inhibării sintezei peretelui celular, au loc alterări în compoziția intracelulară a microorganismului, datorită unor modificări ale presiunii osmotice. Atâta timp cât procesele intracelulare se pot derula, acestea încearcă să compenseze presiunea internă creată de lipsa peretelui celular, însă până în momentul în care celula se distruge. În același timp, lipsa peretelui va permite intrarea altor agenți antibacterieni.[8]
Câteva exemple de antibiotice care acționează la nivelul peretelui celular sunt: toate antibioticele beta-lactamice (penicline, cefalosporine, monobactame, carbapeneme, prin legarea de enzimele responsabile de sinteza peptidoglicanului), antibioticele glicopeptidice (prin împiedicarea legării straturilor de peptidoglican) și bacitracina (prin împiedicarea transportului precursorilor de peptidoglican).[97]
Membrana celulară
modificareO altă categorie de antibiotice este cea care poate produce o lezare directă sau indirectă (prin inhibarea sintezei unor molecule constituente) asupra membranei celulare, efect care se poate manifesta atât la bacterii, cât și la unele specii fungice. Multe dintre molecule țintesc fosfolipidele membranare, care sunt componente lipide cu caracter anionic și vor atrage peptidele antimicrobiene cu caracter cationic, ducând la deformări fizice.[98] Exemple de astfel de peptide includ polimixinele (polimixina B și colistina, care cresc permeabilitatea membranei prin acțiunea similară cu a detergenților) și daptomicina (care se leagă de membrană și produce depolarizarea acesteia).[97]
Acizii nucleici
modificareUnele antibiotice prezintă un efect de blocare a sintezei moleculelor de acizi nucleici (ADN, ARN), a funcției ribozomilor sau a enzimelor care participă la sinteza proteinelor bacteriene, ceea ce duce la formarea unor proteine defectuoase.[8] Dacă se ia în considerare sinteza ADN-ului și a ARN-ului, există mai multe tipuri de enzime implicate în sinteza acestora care pot fi inhibate. În primul rând, chinolonele inhibă topoizomeraza de tipul II (ADN-giraza) și topoizomeraza de tipul IV, absolut necesare pentru replicarea ADN, pentru recombinare și pentru procesele de reparare ale ADN-ului.[75][97] Același mecanism de inhibiție al ADN-girazei este prezentat și de aminocumarine (novobiocina).[79]
Pot exista și alte mecanisme prin inhibare enzimatică. Rifamicinele, clasă din care face parte și rifampicina, se leagă de ARN-polimerază, ceea ce are ca efect inhibarea inițierii sintezei de ARN.[99] Un alt mecanism este cel prezentat de nitroimidazoli și nitrofurani, care se inserează în celula bacteriană și sunt reduse sub acțiunea nitroreductazelor bacteriene la compuși citotoxici care afectează structura acizilor nucleici și a proteinelor.[97][100]
Din aceeași categorie fac parte și substanțele care acționează ca antimetaboliți, care blochează anumite căi metabolice din sinteza precursorilor pentru acizi nucleici (timidină, baze purinice) și duc implicit la inhibarea sintezei acestora. Acești compuși prezintă similitudine structurală cu moleculele endogene care sunt necesare pentru căile metabolice, în special acidul folic, și intră în competiție cu acidul para-aminobenzoic.[101] Deoarece mamifere nu biosintetizează acid folic, antimetaboliții nu interferă cu metabolismul celular al gazdei. Exemple de antimetaboliți sunt: sulfamidele (acționează prin analogie structurală), trimetoprimul (inhibă dihidrofolat-reductaza), dapsona și acidul 4-aminosalicilic.[97][101]
Ribozomii și sinteza proteică
modificareÎn final, cele mai multe clase de antibiotice sunt capabile să inhibeze procesele care au loc la nivelul ribozomului bacterian, diferit structural față de cel eucariot. Ribozomii sunt organitele cu rol în sinteza proteinelor celulare, așadar prin perturbarea funcției sale fie se va opri sinteza proteinelor, fie se vor forma proteine nefuncționale, aberante.[97][102]
Exemple de antibiotice care se leagă de subunitatea 30S a ribozomului sunt aminoglicozidele, tetraciclinele, spectinomicina și capreomicina, iar cele care se leagă de subunitatea 50S a ribozomului sunt macrolidele, streptograminele, lincosamidele, cloramfenicolul, pleuromutilinele și oxazolidinonele.[102][103] Acidul fusidic prezintă un mecanism aparte, fiindcă se leagă de factorul de elongare G implicat în translație.[103] De asemenea, puromicina prezintă simililtudine structurală cu o catenă a ARN-ului de transport, fiind astfel fraudulos incorporat în ribozom și blocând etapa de elongare a catenei polipeptidice.[104]
Clase de antibiotice
modificareExistă mai multe criterii conform cărora se poate face clasificarea antibioticelor, inclusiv pe baza mecanismului lor de acțiune (a se vedea secțiunea de mai sus), a structurii lor chimice sau a spectrului de activitate antimicrobian.[11] În secțiunea de mai jos se va realiza o trecere în revistă a principalelor clase de antibiotice utilizate, pe baza structurii lor chimice, ținând cont și de mecanismul de acțiune.
Beta-lactame
modificareAntibiotice beta-lactamice reprezintă o clasă care reunește o multitudine de compuși ce conțin nucleul beta-lactamic, cele mai frecvente categorii fiind penicilinele, cefalosporinele (inclusiv oxacefeme), carbapenemele și monobactamele.[105] În practică, se mai pot asocia cu inhibitori de beta-lactamază.[106] La rândul lor, peniciline pot fi: aminopeniciline, cu acțiune pe Pseudomonas aeruginosa și rezistente la penicilinaze.[107] Cefalosporinele sunt grupate în cinci generații, pe baza spectrului lor de activitate, efectul asupra bacteriilor Gram-negative crescând cu fiecare generație.[108] Carbapenemele prezintă cel mai larg spectru dintre beta-lactamine și sunt considerate antibiotice de rezervă.[109] Monobactamele prezintă o structură simplă și pot fi utilizate în diverse infecții complicate.[110]
| Denumire | Utilizări frecvente și spectru de activitate[111]:pp 800-808[112]:pp 957 | Efecte adverse[107][108][109][110][113] | Mecanism de acțiune[113][97]:p 166 | |
|---|---|---|---|---|
| Peniciline | ||||
| Amoxicilină |
|
Interferă cu procesul de transpeptidare necesar sintezei de peptidoglican și astfel inhibă formarea peretelui celular. | ||
| Ampicilină | ||||
| Azlocilină | ||||
| Carbenicilină | ||||
| Cloxacilină | ||||
| Dicloxacilină | ||||
| Flucloxacilină | ||||
| Mezlocilină | ||||
| Meticilină | ||||
| Nafcilină | ||||
| Oxacilină | ||||
| Penicilină | ||||
| Piperacilină | ||||
| Ticarcilină | ||||
| Cefalosporine (de prima generație) | ||||
| Cefadroxil | Otite, infecții de tract urinar, infecții de tract respirator. Coci Gram-pozitivi, Proteus, Escherichia coli și Klebsiella. Activitate slabă pe bacterii Gram-negative.[108] |
|
Idem | |
| Cefazolină | ||||
| Cefalotină | ||||
| Cefalexină | ||||
| Cefradină | ||||
| Cefalosporine (de a doua generație) | ||||
| Cefaclor | Diverse infecții cu bacterii sensibile. Mai eficiente decât penicilinele față de bacili Gram-negativi, dar la fel față de coci și Gram-pozitivi:[108][8] Haemophilus influenzae, Enterobacter, Neisseria, Proteus, Escherichia coli și Klebsiella. |
|
Idem | |
| Cefamandol | ||||
| Cefoxitină | ||||
| Cefprozil | ||||
| Cefuroximă | ||||
| Cefalosporine (de a treia generație) | ||||
| Cefiximă |
|
Idem | ||
| Cefdinir | ||||
| Cefditoren | ||||
| Cefoperazonă | ||||
| Cefotaximă | ||||
| Cefpodoximă | ||||
| Ceftazidimă | ||||
| Ceftibuten | ||||
| Ceftizoximă | ||||
| Ceftriaxonă | ||||
| Cefalosporine (de a patra generație) | ||||
| Cefepimă | Eficiente în infecții cu Pseudomonas și bacterii Gram-pozitive, active și pe Enterobacteriaceae secretoare de beta-lactamaze, stafilococi și pneumococi sensibili.[108] |
|
Idem | |
| Cefpiromă | ||||
| Cefalosporine (de a cincea generație) | ||||
| Ceftarolină | Eficiente în infecții cu stafilococ auriu meticilino-rezistent (MRSA) și bacterii Gram-negative sensibile, în plus față de celelalte generații.[108] |
|
Idem | |
| Ceftobiprol | ||||
| Carbapeneme | ||||
| Ertapenem |
|
Idem | ||
| Doripenem | ||||
| Imipenem/cilastatin | ||||
| Meropenem | ||||
| Monobactame | ||||
| Aztreonam |
|
Idem | ||
| Carumonam | ||||
| Tigemonam | ||||
| Denumire | Utilizări frecvente | Efecte adverse | Mecanism de acțiune | |
Glicopeptide
modificareAntibiotice glicopeptidice sunt derivați peptidici ciclici glicozilați și sunt utilizate în tratamentul infecțiilor cu bacterii rezistente la alte clase.[114] Primul reprezentant aprobat pentru uz terapeutic a fost vancomicina, iar apoi au fost realizați derivați structurali (dalbavancină, oritavancină și telavancină) cu scopul de a îmbunătăți durata sa de acțiune și tolerabilitatea.[115]
| Denumire | Utilizări frecvente[111]:pp 800-810 | Efecte adverse[113] | Mecanism de acțiune[113][97]:pp 168-169 |
|---|---|---|---|
| Teicoplanină | Infecții cu enterococi, streptococi și stafilococi (inclusiv MRSA), care sunt rezistenți la beta-lactamine sau orice infecții care se pot trata cu beta-lactamine la pacienții cu hipersensibilitate cunoscută la acestea. Infecții cu Clostridium difficile, pneumonie nosocomială, endocardite, infecții severe ale pielii.[114][115][116] |
Reversibile:
|
Întrerup sinteza de peptidoglican și astfel inhibă formarea peretelui celular. |
| Vancomicină | |||
| Dalbavancină | |||
| Oritavancină | |||
| Telavancină |
Polipeptide
modificareAu fost descrie mai multe tipuri de antibiotice peptidice, printre acestea numărându-se și polipeptidele. Ele sunt peptide non-ribozomale, derivate de la aminoacizi, și prezintă utilizări, mecanisme de acțiune și spectre de activitate variate.[117] Unii dintre reprezentanți (bacitracina, de exemplu) sunt toxici în urma administrării injectabile, fiind utilizați strict la nivel topic.[118]
| Denumire | Utilizări frecvente și spectru de activitate[111]:pp 811-812;896 | Efecte adverse[113][119] | Mecanism de acțiune[97]:p 169 |
|---|---|---|---|
| Bacitracină | Infecții topice: oftalmice, auriculare, urinare, de obicei cu aplicare locală, fără uz injectabil. Acțiune pe Gram-pozitive.[118] |
|
Inhibă sinteza componentelor peptidoglicanului necesare pentru formarea peretelui bacterian, dar poate avea și mecanisme de complexare.[120] |
| Tirotricină | |||
| Colistină | Infecții sistemice, cu acțiune pe Gram-negative; nu sunt active pe Gram-pozitive, Proteus și Neisseria.[118] Polimixina B se utilizează și topic, în asociere cu neomicină.[119] | Acționează pe membrana plasmatică bacteriană ca un detergent cationic, alterând permeabilitatea. | |
| Polimixină B |
Aminoglicozide
modificareAntibioticele aminoglicozidice sunt alcătuite din aminozaharide legate de un nucleu aminociclitol prin legături glicozidice.[105] Sunt majoritar produse de către specii din genurile Streptomyces și Micromonospora, iar reprezentanții mai noi au fost obținuți prin semisinteză plecând de la cele naturale.[118] Spectrul lor este larg, având utilizări și în tratamentul tuberculozei. Sunt adesea utilizate în combinație cu alte antibiotice, precum beta-lactame sau vancomicină.[121]
| Denumire | Utilizări frecvente[111]:pp 826-833 | Efecte adverse[113] | Mecanism de acțiune[97]:p 169 |
|---|---|---|---|
| Amikacină |
|
Se leagă de subunitatea 30S a ribozomului bacterian și induc formarea unui ARN nefuncțional, ce duce implicit la inhibarea sintezei proteice. | |
| Gentamicină | |||
| Kanamicină | |||
| Neomicină | |||
| Netilmicină | |||
| Streptomicină | |||
| Tobramicină | |||
| Paromomicină | |||
| Plazomicină |
Chinolone
modificareChinolonele și derivații acestora, fluorochinolonele, prezintă 5 generații de antibiotice cu spectre diferite de acțiune. În ciuda eficienței ridicate, utilizarea lor a fost restrânsă la infecții complicate, care nu răspund la alte tratamente.[123] Au fost obținuți mulți derivați chinolonici, cu scopul îmbunătățirii biodisponibilității, iar denumirea lor se face prin adăugarea sufixului -oxacină sau -floxacină.[106]
| Denumire | Utilizări frecvente[111]:pp 837-840 | Efecte adverse[113][123] | Mecanism de acțiune[97]:p 172 |
|---|---|---|---|
| Ciprofloxacină |
|
Inhibă ADN-giraza și topoizomeraza IV bacteriană, inhibând replicarea și transcripția ADN-ului, însă diferă în selectivitatea pentru aceste enzime.[123] | |
| Enoxacină | |||
| Gatifloxacină | |||
| Levofloxacină | |||
| Lomefloxacină | |||
| Moxifloxacină | |||
| Norfloxacină | |||
| Ofloxacină | |||
| Trovafloxacină |
Tetracicline
modificareAntibioticele tetraciclice, denumite și tetracicline, sunt antibiotice cu spectru larg, derivate de tetracen parțial hidrogenat,[105] care sunt produse de specii de Streptomyces sau sunt derivați semisintetici ai tetraciclinelor naturale. Prezintă mecanism bacteriostatic și sunt utilizate de multă vreme în diferite infecții bacteriene. Principalul dezavantaj legat de acești compuși este rezistența pe care au dezvoltat-o unele tulpini, ceea ce a restrâns utilizarea lor clinică.[124] Reprezentanți mai noi, precum este tigeciclina (o glicilciclină derivată de la minociclină), prezintă activitate pe speciile rezistente la alte tetracicline.[118] Denumirea lor se face prin adăugarea sufixului -ciclină.[106]
| Denumire | Utilizări frecvente și spectru de activitate[111]:pp 815-818 | Efecte adverse[113][124] | Mecanism de acțiune[97]:p 170-171 |
|---|---|---|---|
| Demeclociclină |
|
Se leagă de subunitatea 30S a ribozomului bacterian și inhibă sinteza proteică. | |
| Doxiciclină | |||
| Minociclină | |||
| Oxitetraciclină | |||
| Tetraciclină | |||
| Tigeciclină |
Macrolide
modificareAntibioticele macrolidice sunt caracterizate prin prezența unui macrociclu lactonic format din 14, 15 sau 16 atomi, la care sunt atașate amino- și dezoxi-zaharide,[105][118] și au fost descoperite pentru prima dată la bacteria Streptomyces erythreus.[126] S-a dezvoltat și o nouă clasă, cea a ketolidelor, care sunt derivați semisintetici ai eritromicinei cu spectru mai larg de activitate.[127]
| Denumire | Utilizări frecvente și spectru de activitate[111]:pp 818-821 | Efecte adverse[113] | Mecanism de acțiune[97]:p 171 |
|---|---|---|---|
| Azitromicină |
|
Se leagă de subunitatea 50S a ribozomului bacterian, mai exact pe situsul P, inhibând sinteza proteică.[126] | |
| Claritromicină | |||
| Diritromicină | |||
| Eritromicină | |||
| Roxitromicină | |||
| Troleandomicină | |||
| Telitromicină | Este o ketolidă utilizată în pneumonie și în alte infecții severe. Prezintă activitate bună pe Gram-pozitive, în special pe care dau infecții de tract respirator, și pe bacterii rezistente la alte macrolide.[127] |
| |
| Spectinomicină | Este un aminociclitol, utilizat în infecții urinare cauzate de gonococi, gonoree.[129][130] |
Lincosamide
modificareLincosamidele, cu doi reprezentați utilizați clinic (lincomicina și clindamicina) sunt derivați de pirolidină legată printr-o punte aminică de o piranoză. Sunt antibioticele bacteriostatice de elecție în dermatologia veterinară, fiind absorbite rapid în pielea infectată.[131]
| Denumire | Utilizări frecvente[111]:pp 821 | Efecte adverse[113] | Mecanism de acțiune[97]:p 171 |
|---|---|---|---|
| Clindamicină | Infecții cu organisme anaerobe, acnee, profilaxia pre-chirurgicală și în unele cazuri de infecții cu MRSA. Activitate pe streptococi, stafilococi și pneumococi. Enterococii și bacteriile Gram-negative aerobe sunt rezistente.[132] | Colită pseudomembranoasă prin suprainfectare cu Clostridium difficile.[133] | Se leagă de unitatea 50S a ribozomului bacterian și inhibă sinteza proteică.[134] |
| Lincomicină | Acnee de cauză bacteriană, profilaxia pre-chirurgicală. Activitate pe unele microorganisme ca Actinomycetes, Mycoplasma și unele specii de Plasmodium. |
Streptogramine
modificareStreptograminele sunt antibiotice produse de specii de Streptomyces, iar fiecare streptogramină reprezintă un amestec de doi compuși, neînrudiți structural, care prezintă un efect bactericid sinergic de 10 până la 100 de ori mai mare comparativ cu componentele libere.[135] Astfel, fiecare unitate va conține o streptogramină de grup A (macrolactone polinesaturate, precum virginiamicină M sau pristinamicină II) și o streptogramină de grup B (hexadepsipeptide ciclice, precum virginiamicină S sau pristinamicină I).[136]
| Denumire | Utilizări frecvente și spectru de activitate[111]:pp 822-823 | Efecte adverse[135] | Mecanism de acțiune[113][97]:p 172 |
|---|---|---|---|
| Pristinamicină | Combinații sinergice formate din două componente (chinupristina-dalfopristina în raport 30:70). Efect bactericid pe majoritatea bacteriilor, cu mențiunea că Enterococcus faecium este eliminat mai lent. Activitate bună pe tulpini multi-rezistente de streptococi, S. pneumoniae, MRSA și VRE.[137] |
|
Componenta din grupul A se leagă de subunitatea 50S a ribozomului bacterian și produce o modificare structurală care permite și legarea componentei din grupul B, ceea ce duce la amplificarea inhibării sintezei proteice.[138] |
| Virginiamicină | |||
| Chinupristină și dalfopristină |
Rifamicine
modificareRifamicinele sunt antibiotice bactericide care sunt utilizate în tratamentul combinat al tuberculozei (cu excepția rifaximinei, care are un spectru de activitate mai restrâns). Sunt foarte similare în ceea ce privește farmacocinetica și reacțiile adverse produse.[139][140]
| Denumire | Utilizări frecvente și spectru de activitate[111]:pp 845[140] | Efecte adverse[113] | Mecanism de acțiune[97]:p 172 |
|---|---|---|---|
| Rifabutină |
|
Se leagă și inhibă ARN-polimeraza de care este dependentă sinteza proteică bacteriană.[139] | |
| Rifampicină | |||
| Rifapentină | |||
| Rifaximină | Diareea călătorului cauzată de Escherichia coli, sindromul de colon iritabil și encefalopatia hepatică. |
|
Sulfamide
modificareSulfamide sau sulfonamidele antimicrobiene sunt derivați de sinteză care prezintă efect bacteriostatic (asocierea cu trimetoprim le face bactericide).[141] Reprezintă prima clasă de antibiotice care au fost folosite în tratamentul infecțiilor, începând cu anii 1930, însă astăzi au mai rămas doar câțiva reprezentați în uz.[106]
| Denumire | Utilizări frecvente și spectru de activitate[111]:pp 834-836 | Efecte adverse[113][106][142] | Mecanism de acțiune[97]:p 172 |
|---|---|---|---|
| Sulfacetamidă |
|
Intră în competiție cu acidul para-aminobenzoic, prevenind sinteza de acid folic, absolut necesar la nivel bacterian. Astfel, sunt antimetaboliți. | |
| Sulfadiazină (argentică) | |||
| Sulfametizol | |||
| Sulfanilamidă | |||
| Sulfasalazină | |||
| Sulfatiazol | |||
| Sulfizoxazol | |||
| Trimetoprim/sulfametoxazol (Co-trimoxazol) |
Nitroderivați
modificareNitrofuranii și nitroimidazolii sunt agenți chimioterapeutici sintetici care sunt nitroderivați heterociclici și care prezintă un mecanism de acțiune similar, fiind utilizați în unele infecții bacteriene și protozoarice. În ciuda similarității structurale, există unele diferențe în ceea ce privește spectrul de activitate.[145][146][147][148]
| Denumire | Utilizări frecvente și spectru de activitate[111]:pp 895-897 | Efecte adverse[113][100] | Mecanism de acțiune[97]:p 172 |
|---|---|---|---|
| Nitroimidazoli | |||
| Metronidazol | O gamă largă de infecții. Spectru larg de acțiune, pe Gram-pozitive și Gram-negative, anaerobe (inclusiv Bacteroides și Clostridium) dar și pe protozoare (Trichomonas vaginalis, Entamoeba histolytica, Giardia lamblia).[147][12] |
|
Printre altele, produc metaboliți toxici prin activare, iar aceștia inhibă unele enzime microbiene implicate în sinteza ADN-ului și ARN-ului și în unele procese metabolice.[150][148] |
| Ornidazol | |||
| Secnidazol | |||
| Tinidazol | |||
| Nitrofurani | |||
| Furazolidonă |
|
Idem[100][151] | |
| Nifuroxazid | |||
| Nitrofurantoină | |||
| Nitrofurazonă | |||
| Nifurtimox | |||
Alte clase
modificare| Denumire | Clasa | Utilizări frecvente și spectru de activitate | Efecte adverse[113] | Mecanism de acțiune[97] |
|---|---|---|---|---|
| Acid fusidic | Steroid | Infecții cu bacterii Gram-pozitive (Staphylococcus, Streptococcus și Corynebacterium).[153] | Tulburări gastrointestinale[154] | Se leagă de factorul de elongare G implicat în translație și inhibă sinteza proteică.[103] |
| Clofazimină Dapsonă |
Antileproase | În principal în lepră.[155] | Colorarea în roșu-brun a ochilor și pielii (clorafazimină).[156] | - |
| Cloramfenicol Florfenicol Tiamfenicol |
Amfenicoli | Infecții produse de bacterii Gram-pozitive și Gram-negative, anaerobe, spirochete, specii de Rickettsia și Chlamydia.[111]:pp 822[129] | Toxicitate dependentă de doză, cu risc de anemie aplastică.[157] | Se leagă de subunitatea 50S a ribozomului bacterian, inhibând sinteza proteică.[103] |
| Etambutol | Antituberculos | Tuberculoză, în asociere cu alte antituberculoase.[158][159] | Nevrită optică.[160] | Inhibă sinteza peretelui celular bacterian. |
| Fosfomicină | Oxid de etilenă | Unele infecții de tract urinar, cu activitate bună pe stafilococi, enterococ, E. Coli, Salmonella și Shigella.[111]:pp 810[129][161] Uneori se asociază cu trometamol.[162] | Bine tolerat (efecte gastrointestinale ușoare)[162] | Inhibă sinteza peretelui celular bacterian prin inhibarea unor enzime ce formează peptidoglicanul.[161] |
| Izoniazidă (HIN) | Antituberculos | Tuberculoză, în asociere cu alte antituberculoase.[111]:pp 842[159] | Diverse; cea mai cunoscută este hepatotoxicitatea.[163] | Inhibă sinteza acizilor micolici.[164] |
| Linezolid Tedizolid |
Oxazolidinone | Infecții date de bacterii Gram-pozitive: stafilococi (și MRSA), streptococi, enterococi (și VRE), coci anaerobi, Corynebacterium, Nocardia sp, L. monocytogenes și Mycobacterium tuberculosis.[111]:pp 823[165] | Trombocitopenie și alte tulburări hematologice[166] | Se leagă de subunitatea 50S a ribozomului bacterian, inhibând sinteza proteică.[167] |
| Mupirocină | Acid pseudomonic | Aplicat topic în infecții date de coci Gram-pozitivi, inclusiv MRSA.[111]:pp 896 | - | Inhibă sinteza proteică.[168] |
| Pirazinamidă | Antituberculos | Tuberculoză, în asociere cu alte antituberculoase.[159] | Dureri articulare ușoare.[169] | - |
| Retapamulină Lefamulină |
Pleuromutiline | Activitate pe coci Gram-pozitivi, inclusiv MRSA. Retapamulina se utilizează topic, iar lefamulina injectabil.[170][171] | - | - |
Utilizări medicale
modificareAntibioticele sunt utilizate în profilaxia și tratamentul infecțiilor bacteriene,[172] și uneori a infecțiilor produse de protozoare (adesea, se utilizează metronidazolul).[12][13] În practica medicală, este aplicat conceptul de terapie empirică, iar în momentul în care se pune diagnosticul unei infecții bacteriene, dar nu se cunoaște agentul patogen, se administrează un antibiotic cu spectru larg (pe baza simptomatologiei) și se inițiază antibiograma (a cărei realizare poate dura câteva zile).[19]
Pe de altă parte, în contextul cunoașterii microorganismului patogen sau al identificării acestui prin antibiogramă, se poate începe terapia definitivă, de obicei cu un antibiotic cu spectru mai îngust de acțiune. Alegerea terapiei se face având în vedere diferiți factori, precum natura și sensibilitatea patogenului, toxicitatea antibioticului și costul terapiei.[19]
Măsurile de profilaxie prin tratament cu antibiotice sunt aplicate în special în cazul pacienților care prezintă o susceptibilitate ridicată pentru dezvoltarea de infecții bacteriene, precum cei imunocompromiși (ca urmare a infecției cu HIV, pentru prevenirea pneumoniilor), pacienții aflați sub tratament cu imunosupresoare, pacienții bolnavi de cancer sau la cei care urmează să aibă o intervenție chirurgicală.[172][173] Se remarcă o importanță mare a antibioterapiei profilactice în chirurgia stomatologică, utilizând la prevenirea bacteriemiei și a dezvoltării de endocardite infecțioase.[173] O altă aplicație a profilaxiei este la pacienții cu neutropenie, de obicei bolnavi de cancer, care sunt predispuși la dezvoltarea de infecții.[174][175]
În cazul antibioterapiei, succesul terapeutic depinde de mai mulți factori, inclusiv particularitățile pacientului, localizarea infecției și proprietățile farmacocinetice și farmacodinamice ale antibioticului utilizat.[176] Problema rezistenței la antibiotice nu trebuie contracarată neapărat prin dezvoltarea de noi compuși, ci se poate aplica o terapie combinată, în care cel puțin două antibiotice cu mecanisme de acțiune diferite se utilizează împreună (de exemplu, în tuberculoză).[177][178]
Administrare
modificareÎn tratamentul cu antibiotice, se pot alege mai multe căi de administrare. De obicei, se recurge la administrarea orală (per os), iar în cazuri severe, în particular în cazul infecțiilor sistemice, se recurge la administrarea prin injectare intravenoasă.[3][19][20] Administrarea antibioticelor trebuie realizată cât mai rapid posibil, în special în cazul infecțiilor care pun viața în pericol, fapt pentru care multe unități de urgență dețin antibiotice.[179]
În cazul infecțiilor necomplicate, care sunt localizate la nivel topic, administrarea preferată este la acest nivel, fie sub formă de picături oftalmice (în conjunctivită) sau de picături auriculare (în otită), dar și pentru tratamentul unor infecții cutanate, prin diverse forme farmaceutice.[180] Aplicarea antibioticelor la nivel topic oferă avantajul unei concentrații susținute la locul infecției, ceea ce pe de-o parte reduce absorbția sistemică și riscul de toxicitate, și pe de altă parte presupune utilizarea unor volume mici, ceea ce reduce riscul de utilizare neconformă.[181] A fost raportată și reducerea riscului de infectare al rănilor post-chirurgicale prin aplicarea cutanată de antibiotice la nivelul acestora.[182] În ciuda acestor fapte, administrarea topică nu permite un control exact al dozei, iar la acest nivel pot apărea reacții de hipersensibilitate sau dermatite de contact.[181]
O terapie cu antibiotic trebuie să fie inițiată doar cu prescripția eliberată de un specialist medical autorizat, care are de asemenea obligația să monitorizeze evoluția tratamentului. Totuși, există multe cazuri de automedicație în rândul tratamentului cu antibiotice, prin procurarea directă a acestora de către pacienți din farmacii, o practică cu potențial periculos și care duce la agravarea fenomenului de rezistență la antibiotice.[183][21]
Efecte adverse
modificareDatorită variației atât de mare între agenții antimicrobieni, este dificil să se facă o generalizare cu privire la efectele adverse obținute ca urmare a administrării acestora, cu atât mai mult cu cât intervin și factorii care țin de fiecare pacient în parte. În plus, terapia antibiotică produce de obicei puține efecte adverse, este de obicei bine tolerată, iar efectul benefic terapeutic este superior efectelor toxice.[9]
Adesea sunt observate febra, senzația de greață și disconfortul gastrointestinal, precum apariția unor reacții alergice cutanate.[9] Una dintre cele mai comune reacții adverse este diareea asociată cu colită pseudomembranoasă. Aceasta apare ca urmare a perturbării florei normale de la nivel intestinal, ceea ce îi permite bacteriei anaerobe Clostridium difficile să prolifereze la acest nivel, deoarece specia este rezistentă la acțiunea majorității antibioticelor uzuale, dar se dezvoltă în lipsa bacteriilor benefice.[9][184][185] În aceeași ordine de idei, aceste dezechilibre ale microbiotei nu sunt localizate doar la nivel intestinal, ci pot să apară și la nivel vaginal, ducând la instalarea unei candidoze.[186] Unele reacții adverse sunt specifice anumitor clase de antibiotice, cum sunt de exemplu nefrotoxicitatea în cazul aminoglicozidelor, colorarea dinților în cazul tetraciclinelor și riscul de afectare al tendoanelor în cazul chinolonelor.[9][123]
Interacțiuni
modificareDe asemenea, interacțiunile medicamentoase cu alți compuși terapeutici pot induce reacții secundare, cum este de exemplu cazul asocierii chinolonelor și corticosteroizilor, cu risc mare de afectare a tendoanelor. Se mai pune problema interacției cu contraceptivele orale, însă studiile realizate au semnalat faptul că antibioticele prezintă un risc foarte mic de scădere a eficacității acestora.[187][188][189]
Un alt subiect controversat este interacțiunea ce apare ca urmare a consumului de alcool în timpul tratamentului antimicrobian. Se cunoaște faptul că alcoolul poate produce efecte secundare și poate scădea eficacitatea terapeutică a unor antibiotice.[190] Deși consumul moderat de alcool nu produce interacțiuni semnificative cu antibioticele comune, în cazul anumitor tipuri de antibiotice (metronidazol, tinidazol, linezolid) pot apărea reacții adverse severe.[191] În concluzie, potențialul de instalare al efectelor adverse și respectiv scăderea eficacității terapeutice a antibioticelor depinde de tipul acestora.[192]
Antibioticele din anumite clase, precum cefalosporinele,[193][194] metronidazolul, tinidazolul[195] și furazolidona, pot cauza o reacție adversă de tip „disulfiram-like”, prin inhibarea aldehid-dehidrogenazei responsabilă de metabolizarea alcoolul, aceasta manifestându-se prin greață, vomă și senzație de sufocare.[191][196]
Abuzul de antibiotice
modificarePrin abuzul de antibiotice se poate înțelege administrarea acestora atunci când nu există o infecție bacteriană, de exemplu într-o infecție virală, precum este gripa,[22] dar și oprirea administrării de antibiotic înaintea finalizării tratamentului, din cauza îmbunătățirii simptomatologiei. Toate aceste practici duc la dezvoltarea de rezistență la antibiotice.[197]
Animale
modificareExistă o dezbatere cu privire la necesitatea includerii antibioticelor în dieta animalelor sănătoase crescute în ferme. Principalul aspect negativ este legat de faptul că aceste practici duc în mod cert la dezvoltarea rezistenței la antibiotice, atât în cazul bacteriilor din sol,[198] cât și în cazul bacteriilor patogene care produc boli la om, precum sunt cele din genurile Salmonella, Campylobacter, Escherichia și Enterococcus.[7] În plus, s-a constatat că emisia de metan în materiile fecale ale vitelor tratate cu tetraciclină sunt crescute cu aproape 80% în comparație cu cele eliminate de animalele netratate.[199] Impactul asupra faunei este vizibil, un exemplu ilustrativ fiind faptul că tetraciclina ajunsă în materiile fecale modifică flora intestinală a gândacului Aphodius fossor.[199]
În ciuda acestor fapte, aceste practici sunt încă perpetuate în țările dezvoltate, datorită intereselor economice ale fermelor. Antibioticele utilizate la animalele de fermă induce o creștere mai rapidă a acestora și previn infecțiile care s-ar putea instala la animale.[7] Toate antibioticele care sunt eliminate prin materiile fecale provoacă o presiune de selecție mare asupra bacteriilor patogene, care ulterior pot provoca infecții severe și greu tratabile la om.[200] În anul 2001, se estima că mai mult de 70% dintre antibiotice erau ingerate prin consumul de alimente de origine animală, precum carnea de găină, de porc și de vită.[201]
Mai recent, a fost semnalată prezența bacteriilor rezistente la antibiotice chiar și în organismul vertebratelor marine,[202] fapt cauzat în principal de imposibilitatea eliminării totale a antibioticelor din apele reziduale, întrucât majoritatea sunt hidrosolubile și se degradează foarte greu.[203]
Oameni
modificareAbuzul de antibiotice la om se manifestă prin prescrierea de antibiotice atunci când utilizarea acestora nu este necesară.[204] Utilizarea irațională de antibiotice este o practică frecventă în sistemele de sănătate din țările dezvoltate, iar unele patologii pot să fie agravate printr-un tratament necorespunzător sau prin automedicație irațională. Este raportat destul de frecvent consumul de antibiotice fără prescripție medicală pentru tratamentul gripei.[22][205] Antibioprofilaxia (administrarea antibioticelor înaintea unei potențiale contaminări bacteriene) este o practică absolut necesară în unele cazuri, însă s-a semnalat problema referitoare la practicarea acesteia în domeniul stomatologiei, unde de multe ori se apelează la terapia empirică atunci când nu este necesar.[206]
Există diferite forme prin care se poate interveni pentru reducerea abuzului de antibiotice, atât din partea pacienților, cât și a personalului medical, de exemplu prin reducerea prescripțiilor inadecvate și prin conștientizarea pericolelor implicate.[207] Un rol extrem de important în acest sens ar fi informarea publicului general cu privire la toate problemele care pot fi asociate abuzului de antibiotice.[208] Un exemplu pozitiv este „Ziua europeană a informării despre antibiotice”, care se desfășoară în fiecare an pe 18 noiembrie și care are ca scop informarea cu privire la pericolul pe care îl reprezintă pentru sănătatea publică rezistența la antibiotice și utilizarea prudentă a acestora.[209]
Alternative la antibioterapie
modificareOdată cu dezvoltarea noilor tehnologii de fabricare a medicamentelor biologice, s-a pus și problema formulării unor alternative la antibioticele clasice sau a unor metode de a contracara fenomenul de rezistență. O metodă presupune utilizarea de bacteriofagi, care sunt virusuri capabile să invadeze celula bacteriană și să altereze genele codificatoare responsabile de rezistența la antibiotice.[24][210] Terapia cu bacteriofagi se află deja în stadiile incipiente de cercetare, însă aplicabilitatea sa este încă limitată.[211][212]
De asemenea, sunt cunoscute încă din 1925 bacteriocinele (precum colicina V și lantibioticele), toxine de natură proteică produse de unele specii bacteriene cu scopul de a inhiba creșterea altor bacterii.[213][214] Diferite studii au încercat utilizarea acestor agenți terapeutici ca alternativă la antibiotice.[215] În urma cercetărilor realizate, s-a sugerat utilizarea acestora în infecțiile gastrointestinale, însă până în prezent bacteriocinele nu au avut parte de succes clinic.[216][217]
Rezistența la antibiotice
modificareUnul dintre principalele efecte care survin în urma abuzului de antibiotice este fenomenul de rezistență la antibiotice, care presupune pierderea sensibilității anumitor tulpini bacteriene (care vor fi astfel superioare din punct de vedere fiziologic sau genetic) față de un antibiotic, prin selecție naturală. În contextul infecțiilor, administrarea de antibiotic poate induce creșterea preferențială a bacteriilor rezistente și eliminarea bacteriilor sensibile.[18] Din punct de vedere evolutiv, este de ajuns ca o singură populație mică de bacterii să supraviețuiască unui tratament și să se multiplice, prezentând o sensibilitate mai mică în comparație cu populația care exista la începutul tratamentului. Caracterul de rezistență care a fost dobândit prin supraviețuire va fi transmis următoarelor generații.[218]
Rezistența se poate manifesta prin capacitatea de neutralizare prin degradare a compusului antibiotic, caz care a fost observat la bacteriile din sol care au dezvoltat rezistență la sulfametazină, prezentă în materiile fecale ale porcilor aflați sunt tratament.[198] Supraviețuirea tulpinilor depinde de obicei de transmiterea genetică a factorilor de rezistență,[220] însă dezvoltarea rezistenței poate avea loc și ca urmare a transferului orizontal de gene.[221] În ciuda acestor fapte, dobândirea caracterelor de rezistență necesită un anumit efort din partea microorganismelor, și s-a observat faptul că dacă un antibiotic nu se mai folosește o perioadă, fenomenul este reversibil, cu pierderea virulenței crescute.[222]
Există diverse mecanisme moleculare prin care se poate instala rezistența. În primul rând, unele specii prezintă rezistență intrinsecă la numite antibiotice ca urmare a alcătuirii lor genetice.[223][224] O diferență în codul genetic conduce la diferențe structurale, astfel că o la anumită specie poată să lipsească ținta moleculară căutată de antibiotic. În al doilea rând, rezistența poate fi dobândită prim mutații cromozomiale sau prin achiziția de ADN extracromozomial.[223] Este posibil ca unele mecanisme de rezistență să fi fost transmise de bacteriile care sintetizează antibiotice naturale, chiar și acestea având mecanisme similare de protecție.[225][226] Transmiterea factorilor de rezistență la antibiotice are loc prin transferul vertical în timpul creșterii sau prin recombinarea ADN-ului prin transfer orizontal de gene, de exemplu prin intermediul plasmidelor care codifică acești factori.[220][227]
În trecut, infecțiile bacteriene erau foarte ușor tratabile cu antibiotice simple, precum penicilina, însă pe măsură ce fenomenul de rezistență a luat amploare, au apărut tulpini rezistente la mulți agenți, cum este de exemplu cazul Mycobacterium tuberculosis XDR (engleză Extensively drug-resistant), pentru care tratamentul este greu de instaurat. Această tulpină este rezistentă la izoniazidă, rifampicină, fluorochinolone și cel puțin unul dintre următoarele antituberculoase injectabile: capreomicină, kanamicină sau amikacină.[228] Un alt exemplu bine-cunoscut este Staphylococcus aureus, care în trecut era foarte sensibil la peniciline, însă în prezent aproape toate tulpinile sale sunt rezistente și sunt grupate sub denumirea de stafilococ auriu meticilino-rezistent (MRSA).[219] Exact aceeași situație se regăsește și în cazul enterococului rezistent la vancomicină (VRE).[229] Cei mai frecvenți șase patogeni care au dezvoltat rezistență la antibiotice au fost grupați sub denumirea de grupul ESKAPE, acronim care provine de la denumirea acestora (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp.).[93][230]
Mecanisme de rezistență
modificarePrincipalele mecanisme de rezistență la antibiotice care au fost dezvoltate de către bacterii sunt: modificările moleculei, scăderea permeabilității moleculelor în celulă, schimbarea țintelor moleculare și procesele de natură adaptativă.[231] Dintre acestea, cele mai eficiente metode sunt cele de inactivare chimică a antibioticelor, prin secreția de enzime care alterează strucura lor (prin acetilare, fosforilare, adenilare) sau care distrug toată molecula, fără ca aceasta să mai poată ajunge la ținta moleculară. Modificarea moleculară se regăsește în special la aminoglicozide,[231][232] iar distrugerea compușilor este foarte comună în cazul beta-lactaminelor, întrucât unele bacterii (precum MRSA) produc beta-lactamaze cu spectru extins (penicilinaze, cefalosporinaze), capabile să le inactiveze total.[233] În unele cazuri, rezistența produsă de enzimele inactivatoare poate fi contracarată, prin co-administrarea antibioticului cu un inhibitor de beta-lactamază (de exemplu, amoxicilină și acid clavulanic).[234][235]
Un alt mecanism comun este scăderea permeabilității și creșterea efluxului moleculei din celula bacteriană.[231] Bacteriile au dezvoltat mecanisme prin care să prevină intrarea antibioticului în celulă, ceea ce previne atingerea țintei moleculare, în special la speciile Gram-negative.[236] De asemenea, a fost observată încă din anii 1980 producerea unor sisteme bazate pe pompe de eflux, care efectiv scot din celula bacteriană moleculele de antibiotic.[237] De atunci, o mare varietate de clase de pompe de eflux au fost descrise.[238] Totuși, au fost identificați diverși agenți inhibitori ai pompelor de eflux, care pot fi utilizați pentru reducerea rezistenței manifestate prin acest mecanism.[239] O altă metodă de rezistență a bacteriilor se bazează pe prevenirea antibioticului de a interfera cu ținta moleculară, ceea ce se poate realiza prin protecția locului de legare sau modificarea acestuia, cu scăderea afinității antibioticului.[231] Protejarea țintelor moleculare este relevantă din punct de vedere clinic în special în cazul tetraciclinelor, fluorochinolonelor și acidului fusidic, genele codificatoare fiind denumite Tet(M), Tet(O), Qnr, FusB și FusC.[240][241] Modificarea țintei de acțiune este extrem de comună, și se poate manifesta prin mutații ale genei codificatoare ale țintei, modificări enzimatice la locul de legare sau efectiv prin înlocuirea sau renunțarea la aceasta.[231][242]
În final, bacteriile sunt organisme cu o capacitate adaptativă impresionantă, ceea ce le permite dezvoltarea de mecanisme sofisticate pentru adaptarea la factori de stres din mediu. În această categorie intră și tratamentul cu antibiotice și atacul sistemului imunitar asupra bacteriilor patogene, care s-au adaptat la a fi foarte rezistente asupra distrugerii celulare. Cele mai comune exemple de fenotipuri de rezistență ca urmare a răspunsului adaptativ celular sunt întâlnit clinic la daptomicină și la vancomicină.[243]
Obținere industrială
modificareDatorită faptului că antibioticele cele mai frecvent utilizate prezintă origine naturală, fiind metaboliți secundari produși de către unele microorganisme,[23] au fost depuse multe eforturi în implementarea biotehnologiilor, cu dorința de creștere a productivității și a randamentelor de producție. În cazul penicilinei, de exemplu, tulpinile fungice utilizate la nivel industrial produc de 40.000 de ori mai mult antibiotic decât tulpina pe care a izolat-o Fleming.[244] Mai mult, la finalul anilor 1960 s-a descoperit faptul că bacteriile cresc mai rapid în spațiul cosmic, în aceste condiții având o capacitate mai ridicată de a produce antibiotice, de până la 200% în comparație cu producerea în condițiile obișnuite de pe Pământ.[245] În aceeași ordine de idei, se pare că în condițiile scăzute de gravitație bacteriile dezvoltă foarte rapid rezistență.[246]
În 1945 au fost produse la nivel industrial mai mult de 646 bilioane de unități de penicilină.[248] În 1980, pe primul loc se clasau cefalosporinele, urmate de ampicilină și de tetraciclină; per total, s-a estimat că producția la nivel mondial de antibiotice în acest an a depășit 100.000 de tone.[245] Costul total pentru introducerea unui nou antibiotic pe piața de medicamente, din stadiul de cercetare și până la dezvoltarea sa, este de aproximativ 1.200 de milioane de dolari.[218] Din aceste considerente, în secolul al XXI-lea antibioticele sunt produse pe scară largă la nivel industrial și sunt comercializate în mod competitiv.[249]
Obținerea antibioticelor la nivel industrial, pornind de la microorganisme, presupune utilizarea proceselor biotehnologice de fermentație, adesea prin metoda fed-batch, asigurându-se condiții optime de creștere ale microorganismului pe medii de cultură, în fermentatoare de capacitate mare (peste 100.000 de litri), astfel încât să producă cantități mari de antibiotice.[23][247] Factorii care sunt monitorizați includ saturația oxigenului, temperatura, valoarea pH-ului și nivelele de nutrienți prezente în mediul de cultură, depinzând de fiecare microorganism în parte. Antibioticul, după ce este produs ca urmare a metabolismului microorganismului, este extras și supus unor procese de purificare, care depind de natura compusului.[247] De multe ori se dorește realizarea unei semisinteze, fapt pentru care antibioticul este supus unor reacții chimice care au ca scop adiția unor grupe funcționale suplimentare (de exemplu, fabricarea ampicilinei din penicilină prin introducerea unei grupe amino).[250][251]
O altă abordare prin care se pot obține antibioticele este prin sinteză chimică, prin intermediul unor procese în care nu este necesar să se pornească de la un precursor de origine naturală.[251][252] Au fost raportate și metode sintetice totale de obținere a antibioticelor care sunt obținute în mod normal natural, pornind de la molecule de carbohidrați.[253] Dezvoltarea antimicrobienelor sintetice prezintă anumite limitări, printre care se numără și dificultatea de a procura compuși enantiomeri puri și de a realiza reacții chimice stereo- și regioselective. În ciuda acestui fapt, sinteza chimică prezintă avantajul posibilității de a obține structuri moleculare care nu pot fi produse pe căi naturale.[254]
Numărul de antibiotice cunoscute a crescut de la aproximativ 500 în 1960 la mai mult de 11.000 în 1994, undeva la jumătate dintre acestea fiind produse de către speciile din genul Streptomyces.[14] Reprezentanții genului Streptomyces sunt în continuare investigați pentru posibilitatea producerii de noi antibiotice,[255] dorindu-se modificări genetice care să producă microorganisme ce pot sintetiza antibiotice superioare.[23][256]
Antibiograma
modificareÎn cele mai multe cazuri este posibilă izolarea anumitor tulpini bacteriene patogene și cultivarea acestora în cultură pură. Deoarece prin diferite mecanisme de apărare unele tulpini au dezvoltat o anumită rezistență, și deci există diferențe în ceea ce privește sensibilitatea în cadrul aceleași specii pentru un anumit antibiotic, este absolut necesară realizarea unei antibiograme pentru determinarea acestei sensibilități, la nivel de laborator clinic. Informațiile obținute prin antibiogramă sunt necesare pentru a decide ce tratament antibiotic poate fi instaurat pentru un anumit pacient infectat.[257][258]
Totuși, în cazul unor microorganisme, cultivarea poate să fie un proces dificil și anevoios, precum este cazul speciilor din genul Mycobacterium[259] și al bacteriilor strict anaerobe, care se multiplică doar în medii sărăcite în oxigen (Bacteroides și Fusobacterium).[260] De asemenea, se dorește și identificarea rezistenței unor tulpini anume, precum este stafilococul auriu meticilino-rezistent (MRSA) sau enterococul vancomicino-rezistent (VRE), întrucât acestea produc infecții care sunt foarte greu de tratat.[219][229][261]
Metodele de testare ale sensibilității la antibiotice pot fi de două tipuri: metode calitative (precum este metoda difuzimetrică Kirby-Bauer) sau metode cantitative, cele din urmă utilizând macro- sau microdiluții și putând fi automatizate.[262][263][264]
Metode cantitative
modificareMetodele cantitative sunt cele mai frecvent utilizate pentru determinarea concentrației minime inhibitorii (CMI), a cărei interpretare este absolut necesară în cazul infecțiilor grave, la pacienții imunocompromiși sau la cei care se află în stare critică. CMI reprezintă cea mai mică concentrație de antibiotic care inhibă creșterea vizibilă a unui microorganism după timpul de incubare. Acestea ajută și la confirmarea rezistenței microorganismelor la anumiți agenți antimicrobieni, dar și pentru determinarea standardelor la antibioticele noi.[1][262] CMI se pot determina prin metoda diluțiilor succesive în agar (mediu solid) sau bulion (mediu lichid), în conformitate cu anumite standarde stabilite la nivel național.[1]
Metoda diluțiilor în mediu lichid se bazează pe turbiditatea produsă de bacterii în tuburi sau plăcuțe, în funcție de concentrația de antibiotic prezentă. Acest lucru presupune plecarea de la o suspensie bacteriană standardizată în numărul de unități formatoare de colonii per mililitru (CFU/ml), din care se realizează diluții succesive până la stabilirea CMI. Citirea rezultatelor se poate face vizual sau automat.[1][265] Exact aceeași metodologie se poate aplica și pe medii solide, utilizându-se plăci Petri cu mediu din agar-agar în locul bulionului nutritiv.[265]
O altă metodă cantitativă importantă pentru determinarea rezistenței la antibiotice este metoda E-test, dezvoltată în anii 1980. În aceasta, se plasează pe mediul de cultură pe care a fost inoculată bacteria o bandeletă ce conține un gradient exponențial de antibiotic, iar fiecare CMI este notată la marginea acesteia. La locul de intersecție dintre zona de inhibiție și bandeletă se citește valoare CMI, după cum se poate observa și în figura de mai jos.[264] Metoda a fost adaptată și pentru determinarea sensibilității la fungii patogeni.[266]
Metode calitative
modificareMetodele calitative sunt frecvent utilizate pentru determinarea sensibilității tulpinilor, dar nu oferă informații referitoare la magnitudinea acesteia. Cea mai utilizată metodă este metoda difuzimetrică Kirby-Bauer, în care mici discuri de celuloză impregnate cu mai multe tipuri de antibiotice sunt atașate la suprafața plăcii de cultură pe care tocmai a fost inoculată bacteria. După incubare, se citesc diametrele zonelor de inhibiție, iar cu ajutorul unor tabele se determină dacă tulpina respectivă este sensibilă, intermediar-rezistentă sau rezistentă la un anumit compus antibacterian.[1] Metoda este de obicei aplicată pentru infecțiile de tract urinar sau pentru alte infecții necomplicate.[262] După cum se poate observa și în figurile de mai jos, bacteriile nu se vor dezvolta în jurul discurilor corespunzătoare antibioticelor la care sunt sensibile, iar cele rezistente vor crește indiferent de prezența antibioticului.[257] O altă metodă care se poate utiliza este metoda Schlichter, care determină diluția de plasmă sanguină a pacientului necesară pentru moartea patogenului, și se face în cazul infecțiilor severe cu stafilococi, streptococi și diverse bacterii Gram-negative.[267]
-
Rezultate ale CMI pentru proba E-test
-
Metoda difuzimetrică Kirby-Bauer
-
Comparație dintre două antibiograme: tulpină sensibilă (stânga) și rezistentă (dreapta)
-
Antibiogramă pentru Pseudomonas aeruginosa
-
Antibiogramă pentru Serratia marcescens
Referințe
modificare- ^ a b c d e f Sandle T (). „Antibiotics and preservatives”. Pharmaceutical Microbiology (în engleză). Elsevier. pp. 171–183. doi:10.1016/b978-0-08-100022-9.00014-1.
- ^ „ATC/DDD Index - Code J01 Antiinfectives for systemic use”. Organizația Mondială a Sănătății - Clasificarea anatomică, terapeutică și chimică. Accesat în .
- ^ a b c „Antibiotics”. NHS. . Arhivat din original la . Accesat în .
- ^ Liddell HG, Scott R. Termenul ἀντί. de la: A Greek-English Lexicon - Perseus Project (în engleză). Accesat pe 6 aprilie 2020.
- ^ Liddell HG, Scott R. Termenul βίος. de la: A Greek-English Lexicon - Perseus Project (în engleză). Accesat pe 6 aprilie 2020.
- ^ „Factsheet for experts”. European Centre for Disease Prevention and Control. Arhivat din original la . Accesat în .
- ^ a b c Khachatourians GG (). „Agricultural use of antibiotics and the evolution and transfer of antibiotic-resistant bacteria”. CMAJ (în engleză). 159 (9): 1129–1136. PMC 1229782 . PMID 9835883.
- ^ a b c d „Antibiótico” (în spaniolă). Enciclopedia Microsoft® Encarta® Online. . Arhivat din original la . Accesat în .
- ^ a b c d e Dancer SJ (). „How antibiotics can make us sick: the less obvious adverse effects of antimicrobial chemotherapy”. The Lancet Infectious Diseases (în engleză). 4 (10): 611–619. doi:10.1016/s1473-3099(04)01145-4.
- ^ a b Ocampo PS, Lázár V, Papp B, Arnoldini M, Abel zur Wiesch P, Busa-Fekete R, Fekete G, Pál C, Ackermann M, Bonhoeffer S (iulie 2014). „Antagonism between Bacteriostatic and Bactericidal Antibiotics Is Prevalent” (PDF). Antimicrobial Agents and Chemotherapy (în engleză). 58 (8): 4573–4582. doi:10.1128/AAC.02463-14. PMID 24867991. Arhivat din original (PDF) la . Accesat în .
- ^ a b c Calderon CB, Sabundayo BP (2007). Antimicrobial Classifications: Drugs for Bugs. In Schwalbe R, Steele-Moore L, Goodwin AC. Antimicrobial Susceptibility Testing Protocols. CRC Press. Taylor & Frances group. ISBN: 978-0-8247-4100-6
- ^ a b c Tally FP, Sullivan CE (). „Metronidazole: in vitro activity, pharmacology and efficacy in anaerobic bacterial infections”. Pharmacotherapy (în engleză). 1 (1): 28–38. doi:10.1002/j.1875-9114.1981.tb03551.x. PMID 6927601.
- ^ a b Chemical Analysis of Antibiotic Residues in Food (PDF). John Wiley & Sons, Inc. . pp. 1–60. ISBN 9781449614591.
- ^ a b c Strohl W. R. (). Biotechnology of Antibiotics (în engleză). Informa Health Care. ISBN 0-8247-9867-8.
- ^ Emil Cionga, Liviu Avram (1978): Medicamente chimioterapice, pag. 93. Editura Dacia, Cluj-Napoca
- ^ Fulga I (). „Utilizarea rațională a antibioticelor”. Farmacologie (MedicHub) (3/2019). doi:10.26416/FARM.188.3.2019.2411.
- ^ a b c d e f g h i Zaffiri L., Gardner J., Toledo-Pereyra LH. (). „History of Antibiotics. From Salvarsan to Cephalosporins”. Journal of Investigative Surgery. 25 (5): 67–77. doi:10.3109/08941939.2012.664099.
- ^ a b Levy SB (octombrie 1994). „Balancing the drug-resistance equation”. Trends in Microbiology. 2 (10): 341–2. doi:10.1016/0966-842X(94)90607-6. PMID 7850197.
- ^ a b c d Leekha S, Terrell CL, Edson RS (februarie 2011). „General principles of antimicrobial therapy”. Mayo Clinic Proceedings. 86 (2): 156–67. doi:10.4065/mcp.2010.0639. PMC 3031442 . PMID 21282489.
- ^ a b „Route of Antibiotic Administration”. New England Journal of Medicine (în engleză). 263 (13): 656. . doi:10.1056/nejm196009292631312.
- ^ a b Bauchner H, Wise PH (). „Antibiotics without prescription: "bacterial or medical resistance"?”. The Lancet (în engleză). 355 (9214): 1480. doi:10.1016/s0140-6736(00)02160-7. PMID 10801167.
- ^ a b c „Antibiotic Do's & Don'ts”. Centrul pentru Prevenirea și Controlul Bolilor (SUA). . Accesat în .
- ^ a b c d „Industrial Production of Antibiotics”. Biology LibreTexts. . Accesat în .
- ^ a b Lu TK, Collins JJ (). „Dispersing biofilms with engineered enzymatic bacteriophage”. Proceedings of the National Academy of Sciences, USA (în engleză). 104 (27): 11197–11202. doi:10.1073/pnas.0704624104. PMC 1899193 . PMID 17592147.
- ^ Perry Romanowski. „How Products Are Made: Antibiotics”. Arhivat din original la . Accesat în .
- ^ „Ancient Times - Pharmacology”. Antimicrobial Resistance Learning Site For Veterinary Students. Arhivat din original la . Accesat în .
- ^ Buts JP. (1999) Mechanisms of Action of Biotherapeutic Agents. În: Elmer G.W., McFarland L.V., Surawicz C.M.: Biotherapeutic Agents and Infectious Diseases. Humana Press, Totowa, New Jersey. ISBN 978-1-4757-4652-5 doi:10.1007/978-1-59259-711-6_2
- ^ Forrest RD (martie 1982). „Early history of wound treatment”. Journal of the Royal Society of Medicine. 75 (3): 198–205. PMC 1437561 . PMID 7040656.
- ^ Wainwright, Milton (). „Moulds in ancient and more recent medicine”. Mycologist. 3 (1): 21–23. doi:10.1016/S0269-915X(89)80010-2.
- ^ a b Saxena, Sanjai (). „Chapter 8: Microbes in Production of Fine Chemicals (Antibiotics, Drugs, Vitamins, and Amino Acids”. Applied Microbiology. Springer India. pp. 83–120. doi:10.1007/978-81-322-2259-0. ISBN 978-81-322-2258-3.
- ^ Encyclopædia Britannica Online. „Antibiosis” (în eng). Accesat în .
- ^ H. Landsberg (). „Prelude to the discovery of penicillin”. Isis. 40 (3): 225–227. doi:10.1086/349043.
- ^ Bosch F, Rosich L (). „The contributions of Paul Ehrlich to pharmacology: a tribute on the occasion of the centenary of his Nobel Prize”. Pharmacology. 82 (3): 171–9. doi:10.1159/000149583. PMC 2790789 . PMID 18679046.
- ^ Williams KJ (august 2009). „The introduction of 'chemotherapy' using arsphenamine - the first magic bullet”. Journal of the Royal Society of Medicine. 102 (8): 343–8. doi:10.1258/jrsm.2009.09k036. PMC 2726818 . PMID 19679737.
- ^ a b Goodman, Louis S.; Gilman, Alfred (). The Pharmacological Basis of Therapeutics. New York: Macmillan.
- ^ Williams KJ (). „The introduction of 'chemotherapy' using arsphenamine - the first magic bullet”. J R Soc Med. 102 (8): 343–8. doi:10.1258/jrsm.2009.09k036. PMC 2726818 . PMID 19679737.
- ^ „The Pre-Antibacterial Era - Pharmacology”. Antimicrobial Resistance Learning Site For Veterinary Students. Arhivat din original la . Accesat în .
- ^ a b c „The Golden Age of Antibacterials - Pharmacology”. Antimicrobial Resistance Learning Site For Veterinary Students. Arhivat din original la . Accesat în .
- ^ Bentley, R (). „Different roads to discovery; Prontosil (hence sulfa drugs) and penicillin (hence β-lactams)”. J Ind. Microbiol. Biotechnol. 36: 775–786. doi:10.1007/s10295-009-0553-8.
- ^ Aminov RI (). „A brief history of the antibiotic era: lessons learned and challenges for the future”. Frontiers in Microbiology. 1: 134. doi:10.3389/fmicb.2010.00134. PMC 3109405 . PMID 21687759.
- ^ Wright PM, Seiple IB, Myers AG (august 2014). „The evolving role of chemical synthesis in antibacterial drug discovery”. Angewandte Chemie. 53 (34): 8840–69. doi:10.1002/anie.201310843. PMC 4536949 . PMID 24990531.
- ^ „Physiology or Medicine 1939 – Presentation Speech”. Nobel Foundation. Accesat în .
- ^ Kingston W (iunie 2008). „Irish contributions to the origins of antibiotics”. Irish Journal of Medical Science. 177 (2): 87–92. doi:10.1007/s11845-008-0139-x. PMID 18347757.
- ^ Foster W, Raoult A (decembrie 1974). „Early descriptions of antibiosis”. The Journal of the Royal College of General Practitioners. 24 (149): 889–94. PMC 2157443 . PMID 4618289.
the first scientific observations of the antagonistic actions of various micro-organisms were made ... by William Roberts of Manchester (1874) and John Tyndall of London (1876).
- ^ Foster W, Raoult A (decembrie 1974). „Early descriptions of antibiosis”. The Journal of the Royal College of General Practitioners. 24 (149): 889–94. PMC 2157443 . PMID 4618289.
Both Roberts and Tyndall indicated that the Penicillium molds had some property or had an activity which inhibited bacterial growth.
- ^ Bucci, Roberto; Gallì, Paola (). „Public Health History Corner Vincenzo Tiberio: a misunderstood researcher”. Italian Journal of Public Health (în engleză). 8 (4). ISSN 1723-7815. Arhivat din original la . Accesat în .
- ^ Duchesne, Ernest (). Duchesne's Antagonism between molds and bacteria, an English Colloquial Translation. Tradus de Witty, Michael. ISBN 978-1-5498-1696-3.
- ^ a b Straand, Jørund; Gradmann, Christoph; Simonsen, Gunnar Skov; Lindbæk, Morten (). International Encyclopedia of Public Health: Antibiotic Development and Resistance. Academic Press. p. 200. Accesat în .
- ^ Lax, Eric (). The Mold in Dr. Florey's Coat: The Story of the Penicillin Miracle. Holt Paperbacks. ISBN 978-0-8050-7778-0.
- ^ Tan SY, Tatsumura Y (iulie 2015). „Alexander Fleming (1881-1955): Discoverer of penicillin”. Singapore Medical Journal. 56 (7): 366–7. doi:10.11622/smedj.2015105. PMC 4520913 . PMID 26243971.
- ^ Bud, Robert (). Penicillin: Triumph and Tragedy. Oxford University Press. ISBN 978-0-19-954161-4.
- ^ Fleming A (). „Classics in infectious diseases: on the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae by Alexander Fleming, Reprinted from the British Journal of Experimental Pathology 10:226-236, 1929”. Reviews of Infectious Diseases. 2 (1): 129–39. doi:10.1093/clinids/2.1.129. PMC 2041430 . PMID 6994200.; Reprint of Krylov AK (). „[Gastroenterologic aspects of the clinical picture of internal diseases]”. Terapevticheskii Arkhiv. 63 (2): 139–41. PMID 2048009.
- ^ Sykes R (). „Penicillin: from discovery to product”. Bulletin of the World Health Organization. 79 (8): 778–9. PMC 2566502 . PMID 11545336.
- ^ Jones, David S.; Jones, John H. (). „Sir Edward Penley Abraham CBE. 10 June 1913 – 9 May 1999”. Biographical Memoirs of Fellows of the Royal Society (în engleză). 60: 5–22. doi:10.1098/rsbm.2014.0002. ISSN 0080-4606.
- ^ John H.C.Nayler (). „Early discoveries in the penicillin series”. Trends in Biochemical Sciences (în engleză). 16: 195–197. doi:10.1016/0968-0004(91)90076-8.
- ^ Wainwright, M & Swan, HT (). C.G. Paine And The Earliest Surviving Clinical Records Of Penicillin Therapy. Medical History. 30. pp. 42–56. PMID 3511336. Arhivat din original la . Accesat în .
- ^ Shampo, M. A.; Kyle, R. A. (). „Ernst Chain--Nobel Prize for work on penicillin”. Mayo Clinic Proceedings. 75 (9): 882. doi:10.4065/75.9.882. PMID 10994820.
- ^ Hugh, TB (). „Howard Florey, Alexander Fleming and the fairy tale of penicillin”. The Medical Journal of Australia. 177 (1): 52–53; author 53 53. doi:10.5694/j.1326-5377.2002.tb04643.x. PMID 12436980.
- ^ a b Van Epps HL (). „René Dubos: unearthing antibiotics”. J. Exp. Med. 203 (2): 259. doi:10.1084/jem.2032fta. PMID 16528813.
- ^ Roger Cooter, John Pickstone (2003) Companion to Medicine in the Twentieth Century; Capitolul 2: The Golden Age of Medicine, pag. 21-37; Taylor & Francis, ISBN 0415286034
- ^ a b Mohr K.I.(2016) History of Antibiotics Research. În: Stadler M., Dersch P. (eds) How to Overcome the Antibiotic Crisis. Current Topics in Microbiology and Immunology, volumul 398. Springer, Cham ISBN 978-3-319-49282-7, doi:10.1007/82_2016_499
- ^ Karwehl S, Stadler M (). „Exploitation of fungal biodiversity for discovery of novel antibiotics”. Curr Top Microbiol Immunol. doi:10.1007/82_2016_496.
- ^ Ehrlich J, Gottlieb D, Burkholder PR, Anderson LE, Pridham TG (1948) Streptomyces venezuelae, N. sp., The source of chloromycetin. J Bacteriol 56(4):467–477 PMC 518608 PubMed
- ^ Duggar BM (1948) Aureomycin; a product of the continuing search for new antibiotics. Ann N YAcad Sci 30;51(Art. 2):177-81. PubMed doi:10.1111/j.1749-6632.1948.tb27262.x
- ^ Finlay AC, Hobby GL, P’an SY, Regna PP, Routien JB, Seeley DB, Shull GM, Sobin BA, Vinson IAJW, Kane JH (ianuarie 1950) Terramycin, a new antibiotic. Science ;111(2874):85. PubMed doi:10.1126/science.111.2874.85
- ^ McGUIRE JM, BUNCH RL, ANDERSON RC, BOAZ HE, FLYNN EH, POWELL HM, SMITH JW (iunie 1952). „Ilotycin, a new antibiotic”. Antibiot Chemother (Northfield). 2 (6): 281–3. PMID 24541924.
- ^ Zhanel GG, Walters M, Noreddin A, Vercaigne LM, Wierzbowski A, Embil JM, Gin AS, Douthwaite S, Hoban DJ (). „The ketolides: a critical review”. Drugs (în engleză). 62 (12): 1771–804. doi:10.2165/00003495-200262120-00006. PMID 12149046.
- ^ McCormick MH, McGuire JM, Pittenger GE, Pittenger RC, Stark WM (). „Vancomycin,a new antibiotic. I. Chemical and biologic properties”. Antibiot Annu (în engleză). 3 (12): 606–611. PMID 13355336.
- ^ Somma S, Gastaldo L, Corti A (). „Teicoplanin, a new antibiotic from Actinoplanes teichomyceticus nov. sp”. Antimicrob Agents Chemother (în engleză). 26 (6): 917–923. doi:10.1128/aac.26.6.917. PMC 180050 . PMID 6240963.
- ^ Charney J, Fisher WP, Curran C, Machlowitz RA, Tytell AA (). „Streptogramin, a newantibiotic”. Antibiot Chemother (în engleză). 3 (12): 1283–1286. PMID 24542810.
- ^ Schaffer L, Finkelstein J, Hohn A, Djerassi I (noiembrie 1963). „Lincomycin—a New Antibiotic: Studies in Children Carrying β-Hemolytic Streptococci in Association with Acute Pharyngitis, Tonsillitis, or Both”. Antibiot Chemother (în engleză). 2 (11): 642–645. doi:10.1177/000992286300201110. PMID 14079244.
- ^ Mason DJ, Dietz A, Deboer C (1962) Lincomycin-a new antibiotic. I. Discovery and biologicalproperties Antimicrobial Agents and Chemotherapy 2:554–559
- ^ Meyers BR, Kaplan K, Weinstein L (). „Microbiological and pharmacological behavior of 7-chlorolincomycin”. Appl Microbiol (în engleză). 17 (5): 653–7. PMC 377774 . PMID 4389137.
- ^ Sensi P, Greco AM, Ballotta R (). „Rifomycins. I. Isolation and properties of rifomycin B andrifomycin complex”. Antibiot Annu (în engleză). 7: 262–270. PMID 14444943.
- ^ a b Hooper, DC. (). „Emerging mechanisms of fluoroquinolone resistance”. Emerging Infectious Diseases. 7 (2): 337–41. doi:10.3201/eid0702.010239. PMC 2631735 . PMID 11294736.
- ^ Wentland MP: In memoriam: George Y. Lesher, Ph.D., in Hooper DC, Wolfson JS (eds): Quinolone antimicrobial agents, ed 2., Washington DC, American Society for Microbiology : XIII - XIV, 1993.
- ^ a b Takahashi H, Hayakawa I, Akimoto T (). „The history of the development and changes of quinolone antibacterial agents”. Yakushigaku Zasshi (în japoneză). 38 (2): 161–179. PMID 15143768.
- ^ Grohe K, Heitzer H (1987) Cycloaracylierung von Enaminen, Synthese von4-Chinolon-3-carbonsauren Arhivat în , la Wayback Machine.. Liebigs Annalen der Chemie 1:29–37. doi:10.1002/jlac.198719870106
- ^ a b Hoeksema H.; Johnson J. L.; Hinman J. W. (). „Structural studies on streptonivicin, a new antibiotic”. J Am Chem Soc. 77 (24): 6710–6711. doi:10.1021/ja01629a129.
- ^ Heide L (2014) New aminocoumarin antibiotics as gyrase inhibitors. International Journal of Medical Microbiology. 304(1):31-6. doi:10.1016/j.ijmm.2013.08.013 PubMed
- ^ Sanders WE Jr, Sanders CC (). „Effect Piperacillin/tazobactam: a critical review of the evolving clinical literature”. Clin Infect Dis (în engleză). 22 (1): 107–23. doi:10.1093/clinids/22.1.107. PMID 8824974.
- ^ Zhanel GG1, Lam A, Schweizer F, Thomson K, Walkty A, Rubinstein E, Gin AS, Hoban DJ, Noreddin AM, Karlowsky JA (). „Ceftobiprole: a review of a broad-spectrum and anti-MRSA cephalosporin”. Am J Clin Dermatol (în engleză). 9 (4): 245–54. doi:10.2165/00128071-200809040-00004. PMID 18572975.
- ^ Duplessis, C; Crum-Cianflone, N. F; Crum-Cianflone; Duplessis; Duplessis (februarie 2011). „Ceftaroline: A New Cephalosporin with Activity against Methicillin-Resistant Staphylococcus aureus (MRSA)”. Clinical Medicine Reviews in Therapeutics. 3: a2466. doi:10.4137/CMRT.S1637. PMC 3140339 . PMID 21785568.
- ^ a b Hesterkamp T (2015) Antibiotics clinical development and pipeline. Curr Top Microbiol Immunol.(Springer EBook). doi:10.1007/82_2015_451
- ^ Stahlmann R, Riecke K (2004) Die Infektiologie. 5.3.14.1 Editori: Adam D, Doerr HW, Link H, Lode H (Hrsg.), Springer;
- ^ Jaswant Rai, Gurpreet Kaur Randhawa, and Mandeep Kaur (). „Recent advances in antibacterial drugs”. Int J Appl Basic Med Res (în engleză). 3 (1): 152–163. doi:10.4103/2229-516X.112229. PMC 3678679 . PMID 23776832.
- ^ Fernandes P, Martens E (iunie 2017). „Antibiotics in late clinical development”. Biochemical Pharmacology. 133: 152–163. doi:10.1016/j.bcp.2016.09.025. PMID 27687641.
- ^ Choi, Justin J; McCarthy, Matthew W. (). „Cefiderocol: a novel siderophore cephalosporin”. Expert Opinion on Investigational Drugs. 27 (2): 193–197. doi:10.1080/13543784.2018.1426745. PMID 29318906.
- ^ Conly, Jm; Johnston, Bl (). „Where are all the new antibiotics? The new antibiotic paradox”. Canadian Journal of Infectious Diseases and Medical Microbiology (în engleză). 16 (3): 159–160. doi:10.1155/2005/892058. ISSN 1712-9532. PMC 2095020 . PMID 18159536.
- ^ Godfrey S. Bbosa1, Norah Mwebaza, John Odda, David B. Kyegombe, Muhammad Ntale (). „Antibiotics/antibacterial drug use, their marketing and promotion during the post-antibiotic golden age and their role in emergence of bacterial resistance”. Health (în engleză). 6: 410–425. doi:10.4236/health.2014.65059.
- ^ Aarestrup FM, Seyfarth AM, Emborg HD, Pedersen K, Hendriksen RS, Bager F. (). „Effect of Abolishment of the Use of Antimicrobial Agents for Growth Promotion on Occurrence of Antimicrobial Resistance in Fecal Enterococci from Food Animals in Denmark”. Antimicrobial Agents and Chemotherapy (în engleză). 45 (7): 2054–2059. doi:10.1128/AAC.45.7.2054-2059.2001. PMC 90599 . PMID 11408222.
- ^ Newman DJ, Cragg GM (2016) Natural products as sources of new drugs from 1981 to 2014.J Nat Prod 79:629–661
- ^ a b Pendleton, Jack N; Gorman, Sean P; Gilmore, Brendan F (). „Clinical relevance of the ESKAPE pathogens”. Expert Review of Anti-infective Therapy (în engleză). 11 (3): 297–308. doi:10.1586/eri.13.12. ISSN 1478-7210.
- ^ a b „Antibiotics by Mechanism of Action” (în engleză). Sigma-Aldrich. Accesat în .
- ^ Sahra Kırmusaoğlu, Nesrin Gareayaghi, Bekir S. Kocazeybek (). „Introductory Chapter: The Action Mechanisms of Antibiotics and Antibiotic Resistance”. IntechOpen (în engleză). doi:10.5772/intechopen.85211.
- ^ Wilson G, Miles A (). „Topley and Wilson's principles of bacteriologyand immunity”. Immunology (în engleză) (ed. 5). 8 (5). PMC 1423479 .
- ^ a b c d e f g h i j k l m n o p q r s t Patrick Murray, Ken Rosenthal, Michael Pfaller (octombrie 2015). „17. Antibacterial Agents”. Medical Microbiology (ed. 8). Elsevier. pp. 165–173. ISBN 9780323299565.
- ^ Richard M. Epand, Chelsea Walker, Raquel F. Epand, Nathan A. Magarvey (). „Molecular mechanisms of membrane targeting antibiotics”. Biochimica et Biophysica Acta (BBA) - Biomembranes (în engleză). 1858 (5): 980–987. doi:10.1016/j.bbamem.2015.10.018. ISSN 0005-2736.
- ^ Wehrli W, Abstract (). „Rifampin: mechanisms of action and resistance”. Reviews of Infectious Diseases. 5 (sup. 3): S407–11. doi:10.1093/clinids/5.supplement_3.s407. PMID 6356275.
- ^ a b c d Guay DR (). „An Update on the Role of Nitrofurans in the Management of Urinary Tract Infections”. Drugs (în engleză). 61: 353–364. doi:10.2165/00003495-200161030-00004.
- ^ a b Bhattacharjee M.K. (2016) Antimetabolites: Antibiotics That Inhibit Nucleotide Synthesis. În: Chemistry of Antibiotics and Related Drugs. Springer, Cham. doi:10.1007/978-3-319-40746-3_4 ISBN 978-3-319-40744-9 (în engleză)
- ^ a b Poehlsgaard J, Douthwaite S (). „The bacterial ribosome as a target for antibiotics”. Nature Reviews Microbiology (în engleză). 3 (11): 870–881. doi:10.1038/nrmicro1265.
- ^ a b c d Wilson DN (). „Ribosome-targeting antibiotics and mechanisms of bacterial resistance”. Nature Reviews Microbiology (în engleză). 12 (1): 35–48. doi:10.1038/nrmicro3155.
- ^ Pestka, S. (). „Inhibitors of ribosome functions”. Annu. Rev. Microbiol. 25: 487–562. doi:10.1146/annurev.mi.25.100171.002415. PMID 4949424.
- ^ a b c d Maffioli SI (). „A Chemist's Survey of Different Antibiotic Classes”. Antibiotics (PDF) (în engleză). pp. 1–22. doi:10.1002/9783527659685.ch1.
- ^ a b c d e f g Ebimieowei E, Ibemologi A (). „Antibiotics: Classification and mechanisms of action with emphasis on molecular perspectives”. International Journal of Applied Microbiology and Biotechnology Research (în engleză). 4: 90–101.
- ^ a b c „Penicillins”. The American Society of Health-System Pharmacists. Accesat în .
- ^ a b c d e f g „Cephalosporins”. The American Society of Health-System Pharmacists. Accesat în .
- ^ a b c „Carbapenems”. The American Society of Health-System Pharmacists. Accesat în .
- ^ a b c „Aztreonam”. The American Society of Health-System Pharmacists. Accesat în .
- ^ a b c d e f g h i j k l m n o p q Katzung, Bertram (). „VIII. Chemotherapeutic Drugs”. Basic and Clinical Pharmacology (ed. 14). McGraw-Hill Education. ISBN 978-1259641152.
- ^ Laurence L. Brunton, Randa Hilal-Dandan, Björn C. Knollmann (). „VIII. Chemotherapeutic Drugs”. Goodman & Gilman's: The Pharmacological Basis of Therapeutics (ed. 14). McGraw-Hill Education. ISBN 978-1259641152.
- ^ a b c d e f g h i j k l m n o Robert Berkow. The Merck Manual of Medical Information - Home Edition (ed. 2). Paw Prints. ISBN 978-1435290334.
- ^ a b „Penicillins”. The American Society of Health-System Pharmacists. Accesat în .
- ^ a b Van Bambeke F. (august 2006). „Glycopeptides and glycodepsipeptides in clinical development: a comparative review of their antibacterial spectrum, pharmacokinetics and clinical efficacy” (PDF). Curr Opin Investig Drugs. 7 (8): 740–9. PMID 16955686.
- ^ Chen AY, Zervos MJ, Vazquez JA (mai 2007). „Dalbavancin: a novel antimicrobial”. International Journal of Clinical Practice. 61 (5): 853–63. doi:10.1111/j.1742-1241.2007.01318.x. PMC 1890846 . PMID 17362476.
- ^ Hancock REW, Chapple DS (). „Peptide Antibiotics”. Antimicrob Agents Chemother (în engleză). 43 (6): 1317–1323. PMC 89271 . PMID 10348745.
- ^ a b c d e f Kumar, P. (2017). „Antibiotic Therapy” din: Pharmacology of Specific Drug Groups. Pharmacology and Therapeutics for Dentistry (ed. 7), pag. 457–487. doi:10.1016/b978-0-323-39307-2.00033-3
- ^ a b „Neomycin and Polymyxin B”. The American Society of Health-System Pharmacists. Accesat în .
- ^ Stone JK, Strominger JL (). „Mechanism of Action of Bacitracin: Complexation with Metal Ion and C55-Isoprenyl Pyrophosphate”. PNAS (în engleză). 68 (12): 3223–3227. doi:10.1073/pnas.68.12.3223. PMC 389626 . PMID 4332017.
- ^ „Aminoglycosides”. The American Society of Health-System Pharmacists. Accesat în .
- ^ Zhanel, GG; Lawson, CD; Zelenitsky, S; Findlay, B; Schweizer, F; Adam, H; Walkty, A; Rubinstein, E; Gin, AS; Hoban, DJ; Lynch, JP; Karlowsky, JA (). „Comparison of the Next-Generation Aminoglycoside Plazomicin to Gentamicin, Tobramycin and Amikacin”. Expert Review of Anti-infective Therapy. 10 (4): 459–73. doi:10.1586/eri.12.25. PMID 22512755.
- ^ a b c d „Quinolones”. The American Society of Health-System Pharmacists. Accesat în .
- ^ a b „Tetracyclines”. The American Society of Health-System Pharmacists. Accesat în .
- ^ Rose W, Rybak M (). „Tigecycline: first of a new class of antimicrobial agents”. Pharmacotherapy. 26 (8): 1099–110. doi:10.1592/phco.26.8.1099. PMID 16863487.
- ^ a b „Macrolides”. The American Society of Health-System Pharmacists. Accesat în .
- ^ a b „Ketolides”. The American Society of Health-System Pharmacists. Accesat în .
- ^ David B. Ross (). „The FDA and the Case of Ketek”. N Engl J Med 2007. 356: 1601–1604. doi:10.1056/NEJMp078032.
- ^ a b c E Navas Elorza (). „Tetraciclinas, fenicoles, lincosamidas, polimixinas, espectinomicina, fosfomicina”. Medicine. 8 (70): 3763–3770. doi:10.1016/S0304-5412(02)70698-7.
- ^ „Trobicin”. The American Society of Health-System Pharmacists. Arhivat din original la . Accesat în .
- ^ Rezanka, Tomas; Spizek, Jaroslav; Sigler, Karel (). „Medicinal Use of Lincosamides and Microbial Resistance to Them”. Anti-Infective Agents in Medicinal Chemistry (în engleză). 6 (2): 133–144. doi:10.2174/187152107780361670. ISSN 1871-5214.
- ^ Daum RS (). „Clinical practice. Skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus”. New England Journal of Medicine. 357 (4): 380–390. doi:10.1056/NEJMcp070747. PMID 17652653.
- ^ Thomas C, Stevenson M, Riley TV (). „Antibiotics and hospital-acquired Clostridium difficile-associated diarrhoea: a systematic review” (PDF). J Antimicrob Chemother. 51 (6): 1339–1350. doi:10.1093/jac/dkg254. PMID 12746372.
- ^ „Lincosamides, Oxazolidinones, and Streptogramins”. Merck Manual of Diagnosis and Therapy. Merck & Co. . Arhivat din original la . Accesat în .
- ^ a b „Streptogramins”. The American Society of Health-System Pharmacists. Accesat în .
- ^ Singh SB, Genilloud O, Peláez F (). „2.05 - Terrestrial Microorganisms – Filamentous Bacteria”. În Liu H-W, Mander L. Comprehensive Natural Products II (în engleză). Elsevier. pp. 109–140. doi:10.1016/B978-008045382-8.00036-8. ISBN 9780080453828.
- ^ Allington DR, Rivey MP (ianuarie 2001). „Quinupristin/dalfopristin: a therapeutic review”. Clinical Therapeutics. 23 (1): 24–44. doi:10.1016/S0149-2918(01)80028-X. PMID 11219478.
- ^ Jennie H. Kwon (). „141 - Macrolides, Ketolides, Lincosamides and Streptogramins”. Infectious Diseases (ed. 4). Elsevier. pp. 1217–1229.e1. doi:10.1016/B978-0-7020-6285-8.00141-6. ISBN 9780702062858.
- ^ a b „Rifamycin derivatives”. The American Society of Health-System Pharmacists. Accesat în .
- ^ a b „Rifamycins - Infectious Diseases - Merck Manuals Professional Edition”. Merck Manuals Professional Edition. Accesat în .
- ^ a b „Sulfonamides”. The American Society of Health-System Pharmacists. Accesat în .
- ^ Choquet-Kastylevsky G, Vial T, Descotes J (). „Allergic adverse reactions to sulfonamides”. Curr Allergy Asthma Rep (în engleză). 2: 16–25. doi:10.1007/s11882-002-0033-y. PMID 11895621.
- ^ Heyneman, A; Hoeksema, H; Vandekerckhove, D; Pirayesh, A; Monstrey, S (). „The role of silver sulphadiazine in the conservative treatment of partial thickness burn wounds: A systematic review”. Burns : Journal of the International Society for Burn Injuries. 42 (7): 1377–1386. doi:10.1016/j.burns.2016.03.029. PMID 27126813.
- ^ Scholar E (). „Sulfonamides”. În Enna SJ, David B, Bylund B. xPharm: The Comprehensive Pharmacology Reference (în engleză). Elsevier. pp. 1–4. doi:10.1016/B978-008055232-3.61013-X. ISBN 9780080552323.
- ^ Miura K, Reckendorf HK (). „The Nitrofurans”. The Furans, Reinhold Publishing Corporation. Progress in Medicinal Chemistry (în engleză). 5. pp. 320–381. doi:10.1016/S0079-6468(08)70446-6. ISBN 9780444533241.
- ^ Edwards DI (ianuarie 1993). „Nitroimidazole drugs-action and resistance mechanisms I. Mechanism of action”. Journal of Antimicrobial Chemotherapy (în engleză). 31 (1): 9–20. doi:10.1093/jac/31.1.9.
- ^ a b Mital, A (). „Synthetic Nitroimidazoles: Biological Activities and Mutagenicity Relationships”. Scientia Pharmaceutica (în engleză). 77 (3): 497–520. doi:10.3797/scipharm.0907-14.
- ^ a b Kedderis GL, Miwa GT (). „The metabolic activation of nitroheterocyclic therapeutic agents”. Drug Metabolism Reviews (în engleză). 19 (1): 33–62. doi:10.3109/03602538809049618. PMID 3293954.
- ^ Bendesky A, Menéndez D, Ostrosky-Wegman P. „Is metronidazole carcinogenic?”. Mutation Research/Reviews in Mutation Research (în engleză). 511 (2): 133–144. doi:10.1016/S1383-5742(02)00007-8.
- ^ Ings RMJ, McFadzean JA, Ormerod WE (). „The mode of action of metronidazole in Trichomonas vaginalis and other micro-organisms”. Biochemical Pharmacology (în engleză). 23 (9): 1421–1429. doi:10.1016/0006-2952(74)90362-1. PMID 4364702.
- ^ a b Hall BS, Bot C, Wilkinson SR (). „Nifurtimox activation by trypanosomal type I nitroreductases generates cytotoxic nitrile metabolites”. J Biol Chem (în engleză). 286 (15): 13088–95. doi:10.1074/jbc.M111.230847. PMC 3075655 . PMID 21345801.
- ^ McCalla DR (). „Mutagenicity of nitrofuran derivatives: Review”. Environmental Mutagenesis (în engleză). 5 (5): 745–765. doi:10.1002/em.2860050512. PMID 6311528.
- ^ Leclercq, R; Bismuth, R; Casin, I; Cavallo, JD; Croize, J; Felten, A; Goldstein, F; Monteil, H; Quentin-Noury, C; Reverdy, M; Vergnaud, M; Roiron, R (). „In Vitro Activity of Fusidic Acid Against Streptococci isolated form Skin and Soft Tissue Infections”. J. Antimicrob. Chemother. 45 (1): 27–29. doi:10.1093/jac/45.1.27. PMID 10629009.
- ^ Christiansen K (). „Fusidic acid adverse drug reactions”. International Journal of Antimicrobial Agents (în engleză). 12 (2): S3–S9. doi:10.1016/S0924-8579(98)00068-5. PMID 10528781.
- ^ Suzuki K, Akama T, Kawashima A, Yoshihara A, Yotsu RR, Ishii N (februarie 2012). „Current status of leprosy: epidemiology, basic science and clinical perspectives”. The Journal of dermatology. 39 (2): 121–9. doi:10.1111/j.1346-8138.2011.01370.x. PMID 21973237.
- ^ Ramu G, Iyer GG (). „Side effects of clofazimine therapy”. Leprosy in India (în engleză). 48 (4 Suppl): 722–731. PMID 1026810.
- ^ Rich M, Ritterhoff R, Hoffmann R (). „A fatal case of aplastic anemia following chloramphenicol (chloromycetin) therapy”. Ann Intern Med. 33 (6): 1459–1467. PMID 14790529.
- ^ Yendapally R, Lee RE (). „Design, synthesis, and evaluation of novel ethambutol analogues”. Bioorg. Med. Chem. Lett. 18 (5): 1607–1611. doi:10.1016/j.bmcl.2008.01.065. PMC 2276401 . PMID 18242089.
- ^ a b c Nolan CM, Goldberg SV (). „Treatment of isoniazid-resistant tuberculosis with isoniazid, rifampin, ethambutol, and pyrazinamide for 6 months”. The International Journal of Tuberculosis and Lung Disease (în engleză). 6 (11): 952–958. PMID 12475140.
- ^ Lim SA (). „Ethambutol-associated optic neuropathy” (PDF). Ann. Acad. Med. Singap. 35 (4): 274–278. PMID 16710500.
- ^ a b Silver LL (). „Fosfomycin: Mechanism and Resistance”. Cold Spring Harb Perspect Med (în engleză). 7 (2): a025262. doi:10.1101/cshperspect.a025262. PMID 28062557. PMC 5287057
- ^ a b Michalopoulos AS, Livaditis AG, Gougoutas V (). „The revival of fosfomycin”. International Journal of Infectious Diseases (în engleză). 15 (11): e732–e739. doi:10.1016/j.ijid.2011.07.007. PMID 21945848.
- ^ Fountain FF, Tolley E, Chrisman CR, Self TH (). „Isoniazid Hepatotoxicity Associated With Treatment of Latent Tuberculosis Infection: A 7-Year Evaluation From a Public Health Tuberculosis Clinic”. Chest (în engleză). 128 (1): 116–123. doi:10.1378/chest.128.1.116. PMID 16002924.
- ^ Marrakchi H, Lanéelle M-A, Daffé M (). „Mycolic Acids: Structures, Biosynthesis, and Beyond”. Chemistry and Biology (în engleză). 21 (1): 67–85. doi:10.1016/j.chembiol.2013.11.011.
- ^ Ament PW, Jamshed N, Horne JP (). „Linezolid: its role in the treatment of gram-positive, drug-resistant bacterial infections”. American Family Physician (în engleză). 65 (4): 663–670. ISSN 0002-838X. PMID 11871684. Arhivat din original la . Accesat în .
- ^ Sasaki T, Takane H, Ogawa K, Isagawa S, Hirota T, Higuchi S, Horii T, Otsubo K, Ieiri I (). „Population Pharmacokinetic and Pharmacodynamic Analysis of Linezolid and a Hematologic Side Effect, Thrombocytopenia, in Japanese Patients”. Antimicrobial Agents and Chemotherapy (în engleză). 55 (5): 1867–1873. doi:10.1128/AAC.01185-10. PMC 3088209 . PMID 21357301.
- ^ Swaney SM, Aoki H, Ganoza MC, Shinabarger DL (). „The oxazolidinone linezolid inhibits initiation of protein synthesis in bacteria” (PDF). Antimicrobial Agents and Chemotherapy (în engleză). 42 (12): 3251–3255. ISSN 0066-4804. PMC 106030 . PMID 9835522.[nefuncțională]
- ^ Hughes J, Mellows G (). „Inhibition of isoleucyl-transfer ribonucleic acid synthetase in Echerichia coli by pseudomonic acid”. Biochem J (în engleză). 176 (1): 305–318. doi:10.1042/bj1760305. PMC 1186229 . PMID 365175.
- ^ British Thoracic Society (). „A controlled trial of 6 months chemotherapy in pulmonary tuberculosis, final report: results during the 36 months after the end of chemotherapy and beyond”. Br J Dis Chest. 78 (4): 330–336. doi:10.1016/0007-0971(84)90165-7. PMID 6386028.
- ^ Jones R, Fritsche T, Sader H, Ross J (). „Activity of retapamulin (SB-275833), a novel pleuromutilin, against selected resistant gram-positive cocci”. Antimicrob Agents Chemother. 50 (7): 2583–6. doi:10.1128/AAC.01432-05. PMC 1489758 . PMID 16801451.
- ^ Mendes, R. E.; Farrell, D. J.; Flamm, R. K.; Talbot, G. H.; Ivezic-Schoenfeld, Z; Paukner, S; Sader, H. S. (). „In vitro activity of lefamulin tested against Streptococcus pneumoniae with defined serotypes, including multidrug-resistant isolates causing lower respiratory tract infections in the United States”. Antimicrobial Agents and Chemotherapy. 60: AAC.00627–16. doi:10.1128/AAC.00627-16. PMC 4914675 . PMID 27161634.
- ^ a b Antibiotics Simplified. Jones & Bartlett Publishers. . pp. 15–17. ISBN 9781449614591.
- ^ a b Pallasch TJ, Slots J (). „Antibiotic prophylaxis and the medically compromised patient”. Periodontology 2000 (în engleză). 10: 107–38. doi:10.1111/j.1600-0757.1996.tb00071.x. PMID 9567940.
- ^ Flowers CR, Seidenfeld J, Bow EJ, Karten C, Gleason C, Hawley DK, Kuderer NM, Langston AA, Marr KA, Rolston KV, Ramsey SD (februarie 2013). „Antimicrobial prophylaxis and outpatient management of fever and neutropenia in adults treated for malignancy: American Society of Clinical Oncology clinical practice guideline”. Journal of Clinical Oncology. 31 (6): 794–810. doi:10.1200/JCO.2012.45.8661. PMID 23319691.
- ^ Bow EJ (iulie 2013). „Infection in neutropenic patients with cancer”. Critical Care Clinics. 29 (3): 411–41. doi:10.1016/j.ccc.2013.03.002. PMID 23830647.
- ^ Pankey GA, Sabath LD (martie 2004). „Clinical relevance of bacteriostatic versus bactericidal mechanisms of action in the treatment of Gram-positive bacterial infections”. Clinical Infectious Diseases (în engleză). 38 (6): 864–70. doi:10.1086/381972. PMID 14999632.
- ^ Ocampo PS, Lázár V, Papp B, Arnoldini M, Abel zur Wiesch P, Busa-Fekete R, Fekete G, Pál C, Ackermann M, Bonhoeffer S (august 2014). „Antagonism between bacteriostatic and bactericidal antibiotics is prevalent”. Antimicrobial Agents and Chemotherapy (în engleză). 58 (8): 4573–82. doi:10.1128/AAC.02463-14. PMC 4135978 . PMID 24867991.
- ^ Bonhoeffer S1, Lipsitch M, Levin BR (octombrie 1997). „Evaluating treatment protocols to prevent antibiotic resistance”. Proc Natl Acad Sci USA (în engleză). 94 (22): 12106–11. doi:10.1073/pnas.94.22.12106. PMC 23718 . PMID 9342370.
- ^ Hung, Kevin KC; Lam, Rex PK; Lo, Ronson SL; Tenney, Justin W; Yang, Marc LC; Tai, Marcus CK; Graham, Colin A (). „Cross-sectional study on emergency department management of sepsis”. Hong Kong Medical Journal. 24 (6): 571–578. doi:10.12809/hkmj177149. PMID 30429360.
- ^ Pangilinan R, Tice A, Tillotson G (octombrie 2009). „Topical antibiotic treatment for uncomplicated skin and skin structure infections: review of the literature”. Expert Review of Anti-Infective Therapy. 7 (8): 957–65. doi:10.1586/eri.09.74. PMID 19803705.
- ^ a b Lipsky BA, Hoey C (noiembrie 2009). „Topical antimicrobial therapy for treating chronic wounds”. Clinical Infectious Diseases. 49 (10): 1541–9. doi:10.1086/644732. PMID 19842981.
- ^ Heal CF, Banks JL, Lepper PD, Kontopantelis E, van Driel ML (noiembrie 2016). „Topical antibiotics for preventing surgical site infection in wounds healing by primary intention” (PDF). The Cochrane Database of Systematic Reviews. 11 (11): CD011426. doi:10.1002/14651858.CD011426.pub2. PMID 27819748. PMC 6465080
- ^ Bennadi D (). „Self-medication: A current challenge”. J Basic Clin Pharm (în engleză). 5 (1): 19–23. doi:10.4103/0976-0105.128253. PMC 4012703 . PMID 24808684.
- ^ University of Michigan Health System: Antibiotic-Associated Diarrhea (versiune arhivată), accesat pe 4 aprilie 2020
- ^ Moșneagă DL (martie 2019): Infecția cu Clostridium difficile din perspectiva medicului de familie MedicHub doi:10.26416/MED.127.1.2019.2247
- ^ Pirotta MV, Garland SM (). „Genital Candida species detected in samples from women in Melbourne, Australia, before and after treatment with antibiotics”. J Clin Microbiol. (în engleză). 44: 3213–3217. doi:10.1128/JCM.00218-06. PMID 16954250.
- ^ Anderson KC, Schwartz MD, Lieu SO (ianuarie 2013). „Antibiotics and OC effectiveness”. JAAPA. 26 (1): 11. doi:10.1097/01720610-201301000-00002. PMID 23355994.
- ^ Dickinson B, Altman D; et al. (). „Drug interactions between oral contraceptives and antibiotics”. Obstetrics & Gynecology (în engleză). 98 (5): 853–860. doi:10.1016/s0029-7844(01)01532-0.
- ^ Weisberg E (mai 1999). „Interactions between oral contraceptives and antifungals/antibacterials. Is contraceptive failure the result?”. Clinical Pharmacokinetics. 36 (5): 309–13. doi:10.2165/00003088-199936050-00001. PMID 10384856.
- ^ Lwanga J, Mears, Bingham JS, Bradbeer CS (). „Do antibiotics and alcohol mix? The beliefs of genitourinary clinic attendees”. BMJ (în engleză). 337: a2885. doi:10.1136/bmj.a2885.
- ^ a b „Can I drink alcohol while taking antibiotics?”. NHS Direct (UK electronic health service). Arhivat din original la . Accesat în .
- ^ Moore AA, Whiteman EJ, Ward KT (martie 2007). „Risks of combined alcohol/medication use in older adults”. The American Journal of Geriatric Pharmacotherapy (în engleză). 5 (1): 64–74. doi:10.1016/j.amjopharm.2007.03.006. PMC 4063202 . PMID 17608249.
- ^ Ren S, Cao Y, Zhang X, Jiao S, Qian S, Liu P (). „Cephalosporin Induced Disulfiram-Like Reaction: A Retrospective Review of 78 Cases”. International Surgery (în engleză). 99 (2): 142–146. doi:10.9738/INTSURG-D-13-00086.1. PMID 24670024.
- ^ Kitson TM (). „The effect of cephalosporin antibiotics on alcohol metabolism: a review”. Alcohol (în engleză). 4 (3): 143–8. doi:10.1016/0741-8329(87)90035-8. PMID 3593530.
- ^ Andersson KE (). „Pharmacokinetics of nitroimidazoles. Spectrum of adverse reactions”. Scand J Infect Dis Suppl (în engleză). 26: 60–7. PMID 6941457.
- ^ Karamanakos PN, Pappas P, Boumba VA, Thomas C, Malamas M, Vougiouklakis T, Marselos M (). „Pharmaceutical Agents Known to Produce Disulfiram-Like Reaction: Effects on Hepatic Ethanol Metabolism and Brain Monoamines”. Int J Toxicol (în engleză). 26 (5): 423–32. doi:10.1080/10915810701583010. PMID 17963129.
- ^ VK Viswanathan (). „Off-label abuse of antibiotics by bacteria”. Gut Microbes (în engleză). 5 (1): 3–4. doi:10.4161/gmic.28027. PMC 4049933 . PMID 24637595.
- ^ a b Topp E, Chapman R, Devers-Lamrani M, Hartmann A, Marti R, Martin-Laurent F, Sabourin L, Scott A, Sumarah M (). „Accelerated Biodegradation of Veterinary Antibiotics in Agricultural Soil following Long-Term Exposure, and Isolation of a Sulfamethazine-degrading sp”. Journal of Environmental Quality. 42 (1): 173–8. doi:10.2134/jeq2012.0162. PMID 23673752. Arhivat din original la . Accesat în .
- ^ a b Hammer TJ, Fierer N, Hardwick B, Simojoki A, Slade E, Taponen J, Viljanen H, Roslin T'. (). „Treating cattle with antibiotics affects greenhouse gas emissions, and microbiota in dung and dung beetles”. Proc. R. Soc. B. 283. doi:10.1098/rspb.2016.0150.
- ^ Manyi-Loh C, Mamphweli S, Meyer E, Okoh A (). „Antibiotic Use in Agriculture and Its Consequential Resistance in Environmental Sources: Potential Public Health Implications”. Molecules (în engleză). 23 (4): 795. doi:10.3390/molecules23040795. PMID 29601469. PMC 6017557
- ^ Mellon, M et ál. (). „Hogging It!: Estimates of Antimicrobial Abuse in Livestock” (PDF). Union of Concerned Scientists (ed. 1). Cambridge, MA. Arhivat din original (PDF) la . Accesat în .
- ^ Rose JM, Gast RJ, Bogomolni A, Ellis JC, Lentell BJ, Touhey K, Moore M (). „Occurrence and patterns of antibiotic resistance in vertebrates off the Northeastern United States coast”. FEMS Microbiology Ecology. 67: 421–431. doi:10.1111/j.1574-6941.2009.00648.x.
- ^ Milić N, Milanović M, Letić NG, Sekulić MT, Radonić J, Mihajlović I, Miloradov MV (). „Occurrence of antibiotics as emerging contaminant substances in aquatic environment”. Int J Environ Health Res (în engleză). 23 (4): 296–310. doi:10.1080/09603123.2012.733934. PMID 23067248.
- ^ Ong S, Nakase J, Moran GJ, Karras DJ, Kuehnert MJ, Talan DA (). „Antibiotic use for emergency department patients with upper respiratory infections: prescribing practices, patient expectations, and patient satisfaction”. Ann Emerg Med (în engleză). 50 (3): 213–20.
- ^ Rizky A (). „Antibiotic Abuse in Developing Countries” (PDF). Pharmaceutical Regulatory Affairs (în engleză). 1 (2). doi:10.4172/2167-7689.1000e106.
- ^ Oberoi SS, Dhingra C, Sharma G, SArdana D (). „Antibiotics in dental practice: how justified are we” (în engleză). 65 (1): 4–10. doi:10.1111/idj.12146. PMID 25510967.
- ^ Metlay JP, Camargo CA, MacKenzie T; et al. (). „Cluster-randomized trial to improve antibiotic use for adults with acute respiratory infections treated in emergency departments”. Annals of emergency medicine. 50 (3): 221–230. doi:10.1016/j.annemergmed.2007.03.022. PMID 17509729.
- ^ Hernández-Merino A (). „Prudent use of antibiotics and suggestions for improvement from the paediatric health community”. Enferm Infecc Microbiol Clin (în engleză și spaniolă). 28 (Suppl 4): 23–7. doi:10.1016/S0213-005X(10)70038-0. PMID 21458696.
- ^ Ziua europeană a informării cu privire la utilizarea antibioticelor, Centrul European de Prevenire și Control al Bolilor, accesat în
- ^ Williams SR, Gebhart D, Martin DW, Scholl D (). „Retargeting R-type pyocins to generate novel bactericidal protein complexes”. Applied and Environmental Microbiology. 74 (12): 3868–3876. doi:10.1128/AEM.00141-08. PMC 2446544 . PMID 18441117.
- ^ Abedon ST, Calendar RL, ed. (). The Bacteriophages.
- ^ Mattey M, Spencer J (). „Bacteriophage therapy--cooked goose or phoenix rising?”. Curr. Opin. Biotechnol. (în engleză). 19 (6): 608–612. doi:10.1016/j.copbio.2008.09.001. PMID 18926909.
- ^ Farkas-Himsley H (). „Bacteriocins--are they broad-spectrum antibiotics?”. J. Antimicrob. Chemother. 6 (4): 424–426. doi:10.1093/jac/6.4.424. PMID 7430010.
- ^ Gratia JP (). „André Gratia: a forerunner in microbial and viral genetics”. Genetics. 156 (2): 471–6. PMC 1461273 . PMID 11014798.
- ^ Gillor O, Kirkup BC, Riley MA (). „Colicins and microcins: the next generation antimicrobials”. Adv. Appl. Microbiol. 54: 129–146. doi:10.1016/S0065-2164(04)54005-4. PMID 15251279.
- ^ Kirkup BC (). „Bacteriocins as oral and gastrointestinal antibiotics: theoretical considerations, applied research, and practical applications”. Curr. Med. Chem. (în engleză). 13 (27): 3335–3350. doi:10.2174/092986706778773068. PMID 17168847.
- ^ Lopetuso LR, Giorgio ME, Saviano A, Scaldaferri F, Gasbarrini A, Cammarota G (). „Bacteriocins and Bacteriophages: Therapeutic Weapons for Gastrointestinal Diseases?”. International Journal of Molecular Sciences (în engleză). 20 (1): pii: E183. doi:10.3390/ijms20010183. PMID 30621339.
- ^ a b Fresno Chavez, Caridad (). „El diseño de nuevos antibióticos” (PDF). Revista Cubana de Medicina General Integral (în spaniolă). 17 (2): 196–199. ISSN 0864-2125.
- ^ a b c Waness, Abdelkarim (). „Revisiting methicillin-resistant Staphylococcus aureus infections”. Journal of Global Infectious Diseases (în engleză). 2 (1): 49. doi:10.4103/0974-777x.59251. PMC 2840971 . PMID 20300418.
- ^ a b Witte W (septembrie 2004). „International dissemination of antibiotic resistant strains of bacterial pathogens”. Infection, Genetics and Evolution. 4 (3): 187–91. doi:10.1016/j.meegid.2003.12.005. PMID 15450197.
- ^ Dyer, Betsey Dexter (). „Chapter 9, Pathogens”. A Field Guide To Bacteria . Cornell University Press. ISBN 978-0-8014-8854-2.
- ^ Andersson DI (octombrie 2006). „The biological cost of mutational antibiotic resistance: any practical conclusions?”. Current Opinion in Microbiology. 9 (5): 461–5. doi:10.1016/j.mib.2006.07.002. PMID 16890008.
- ^ a b Alekshun MN, Levy SB (martie 2007). „Molecular mechanisms of antibacterial multidrug resistance”. Cell. 128 (6): 1037–50. doi:10.1016/j.cell.2007.03.004. PMID 17382878.
- ^ Pawlowski AC, Wang W, Koteva K, Barton HA, McArthur AG, Wright GD (decembrie 2016). „A diverse intrinsic antibiotic resistome from a cave bacterium”. Nature Communications. 7: 13803. Bibcode:2016NatCo...713803P. doi:10.1038/ncomms13803. PMC 5155152 . PMID 27929110.
- ^ Marshall CG, Lessard IA, Park I, Wright GD (septembrie 1998). „Glycopeptide antibiotic resistance genes in glycopeptide-producing organisms”. Antimicrobial Agents and Chemotherapy. 42 (9): 2215–20. doi:10.1128/AAC.42.9.2215. PMC 105782 . PMID 9736537.
- ^ Nikaido H (februarie 2009). „Multidrug resistance in bacteria”. Annual Review of Biochemistry. 78 (1): 119–46. doi:10.1146/annurev.biochem.78.082907.145923. PMC 2839888 . PMID 19231985.
- ^ Baker-Austin C, Wright MS, Stepanauskas R, McArthur JV (aprilie 2006). „Co-selection of antibiotic and metal resistance”. Trends in Microbiology. 14 (4): 176–82. doi:10.1016/j.tim.2006.02.006. PMID 16537105.
- ^ Raviglione MC, Smith IM (). „XDR tuberculosis--implications for global public health”. N Engl J Med (în engleză). 356 (7): 656–9. doi:10.1056/NEJMp068273. PMID 17301295.
- ^ a b National Institute of Allergy and Infectious Diseases (NIAID): Vancomycin-Resistant Enterococci (VRE) (în engleză). arhivat pe 30 august 2008; accesat pe 5 aprilie 2020.
- ^ Santajit, Sirijan; Indrawattana, Nitaya (). „Mechanisms of Antimicrobial Resistance in ESKAPE Pathogens”. BioMed Research International (în engleză). 2016: 2475067. doi:10.1155/2016/2475067. ISSN 2314-6133. PMC 4871955 . PMID 27274985.
- ^ a b c d e Jose MM, Cesar AA (aprilie 2016). „Mechanisms of Antibiotic Resistance” (PDF). Microbiol Spectr (în engleză). 4 (2). doi:10.1128/microbiolspec.VMBF-0016-2015. PMC 4888801 . PMID 27227291.
- ^ Ramirez MS, Tolmasky ME (decembrie 2010). „Aminoglycoside modifying enzymes”. Drug Resist Updat (în engleză). 13 (6): 151–71. doi:10.1016/j.drup.2010.08.003. PMID 20833577.
- ^ Paterson DL, Bonomo RA (). „Extended-spectrum beta-lactamases: a clinical update”. Clin Microbiol Rev (în engleză). 18 (4): 657–86. doi:10.1128/CMR.18.4.657-686.2005. PMC 1265908 . PMID 16223952.
- ^ Essack SY (octombrie 2001). „The development of beta-lactam antibiotics in response to the evolution of beta-lactamases”. Pharmaceutical Research. 18 (10): 1391–9. doi:10.1023/a:1012272403776. PMID 11697463.
- ^ Drawz SM, Bonomo RA (ianuarie 2010). „Three decades of beta-lactamase inhibitors”. Clinical Microbiology Reviews. 23 (1): 160–201. doi:10.1128/CMR.00037-09. PMC 2806661 . PMID 20065329.
- ^ Pagès JM, James CE, Winterhalter M (). „The porin and the permeating antibiotic: a selective diffusion barrier in Gram-negative bacteria”. Nat Rev Microbiol (în engleză). 6 (12): 893–903. doi:10.1038/nrmicro1994. PMID 18997824.
- ^ McMurry L, Petrucci RE Jr, Levy SB (). „Active efflux of tetracycline encoded by four genetically different tetracycline resistance determinants in Escherichia coli”. Proc Natl Acad Sci USA (în engleză). 77 (7): 3974–7. doi:10.1073/pnas.77.7.3974. PMC 349750 . PMID 7001450.
- ^ Poole K (). „Efflux-mediated antimicrobial resistance”. J Antimicrob Chemother (în engleză). 56 (1): 20–51. doi:10.1093/jac/dki171. PMID 15914491.
- ^ Marquez B (decembrie 2005). „Bacterial efflux systems and efflux pumps inhibitors”. Biochimie (în engleză). 87 (12): 1137–47. doi:10.1016/j.biochi.2005.04.012. PMID 15951096.
- ^ Connell SR, Tracz DM, Nierhaus KH, Taylor DE (). „Ribosomal protection proteins and their mechanism of tetracycline resistance”. Antimicrob Agents Chemother (în engleză). 47 (12): 3675–81. doi:10.1128/aac.47.12.3675-3681.2003. PMC 296194 . PMID 14638464.
- ^ Aldred KJ, Kerns RJ, Osheroff N (). „Mechanism of Quinolone Action and Resistance”. Biochemistry (în engleză). 53 (10): 1565–1574. doi:10.1021/bi5000564. PMC 3985860 . PMID 24576155.
- ^ Weisblum B (). „Erythromycin resistance by ribosome modification”. Antimicrob Agents Chemother (în engleză). 39 (3): 577–85. doi:10.1128/aac.39.3.577. PMC 162587 . PMID 7793855.
- ^ Pogliano J, Pogliano N, Silverman JA (). „Daptomycin-mediated reorganization of membrane architecture causes mislocalization of essential cell division proteins”. J Bacteriol (în engleză). 194 (17): 4494–504. doi:10.1128/JB.00011-12. PMC 3415520 . PMID 22661688.
- ^ Shu-Jen Chiang (). „Strain improvement for fermentation and biocatalysis processes by genetic engineering technology”. Journal of Industrial Microbiology and Biotechnology (în engleză). 31 (3): 99–108. doi:10.1007/s10295-004-0131-z. Arhivat din original la .
- ^ a b Karen Miller, Dr. Tony Phillips (august 2008). „Making Antibiotics in Space”. NASA Science. Arhivat din original la . Accesat în .
- ^ Madhan R. Tirumalai, Fathi Karouia, Quyen Tran, Victor G. Stepanov, Rebekah J. Bruce, C. Mark Ott, Duane L. Pierson, George E. Fox (). „Evaluation of Acquired Antibiotic Resistance in Escherichia coli Exposed to Long-Term Low-Shear Modeled Microgravity and Background Antibiotic Exposure”. mBio (în engleză). 10 (1): e02637–18. doi:10.1128/mBio.02637-18.
- ^ a b c Najafpour GD (). „Production of Antibiotics”. Biochemical Engineering and Biotechnology (în engleză). pp. 263–279. doi:10.1016/b978-044452845-2/50011-2.
- ^ Parascandola, John. The History of Antibiotics: a Symposium . Publication No. 5, 1980. American Institute of the History of Pharmacy.
- ^ Allen I. Laskin, Geoffrey M. Gadd, Sima Sariaslani (). Advances in Applied Microbiology (în engleză). Academic Press. ISBN 0-444-53191-2.
- ^ Raynor, B.Denise (). „Penicillin and ampicillin”. Primary Care Update for OB/GYNS (în engleză). 4 (4): 147–152. doi:10.1016/s1068-607x(97)00012-7.
- ^ a b Wright PM, Seiple IB, Myers AG (). „The Evolving Role of Chemical Synthesis in Antibacterial Drug Discovery”. Angew Chem Int Ed Engl (în engleză). 53 (34): 8840–8869. doi:10.1002/anie.201310843. PMC 4536949 . PMID 24990531.
- ^ Lukacs G, Ohno M (). Recent Progress in the Chemical Synthesis of Antibiotics (în engleză). 1. Springer-Verlag Berlin Heidelberg. doi:10.1007/978-3-642-75617-7. ISBN 978-3-642-75619-1.
- ^ Tatsuta, K (). „Total synthesis of the big four antibiotics and related antibiotics”. J Antibiot (Tokyo) (în engleză). 66 (3): 107–129. doi:10.1038/ja.2012.126. PMID 23532019.
- ^ Fridman M (). „Catalyst: The Role of Chemistry in Delivering the Next Antimicrobial Drugs” (PDF). Chem (în engleză). 3 (1): 8–10. doi:10.1016/j.chempr.2017.06.004.
- ^ Bhattacharyya BK, Pal SC, Sen SK (). „Antibiotic production by Streptomyces hygroscopicus d1.5: Cultural effect”. Revista de Microbiologia (în engleză). 29 (3). doi:10.1590/S0001-37141998000300003. ISSN 0001-3714.
- ^ Guojun Wang, Takeshi Hosaka y Kozo Ochi (). „Dramatic Activation of Antibiotic Production in Streptomyces coelicolor by Cumulative Drug-Resistance Mutations” (PDF). Applied and Environmental Microbiology (în engleză). 74 (9): 2834–2840. doi:10.1128/AEM.02800-07. Arhivat din original (PDF) la . Accesat în .
- ^ a b Joanne Willey, Linda Sherwood, Christopher J. Woolverton (). Prescott's Microbiology (ed. 10). McGraw-Hill. pp. 840–841. ISBN 9781259281594.
- ^ Joshi S (). „Hospital antibiogram: a necessity”. Indian J Med Microbiol (în engleză). 28 (4): 277–80. doi:10.4103/0255-0857.71802. PMID 20966554.
- ^ Barry R. Bloom, ed. (). „Chapter 6 : Cultivation of Mycobacterium tuberculosis for Research Purposes”. Tuberculosis: Pathogenesis, Protection, and Control (în engleză). doi:10.1128/9781555818357.ch6. ISBN 9781555819101.
- ^ Brook I, Long SS (). „187 - Anaerobic Bacteria: Classification, Normal Flora, and Clinical Concepts”. Principles and Practice of Pediatric Infectious Diseases (în engleză) (ed. 5). Elsevier. pp. 987–995.e2. doi:10.1016/B978-0-323-40181-4.00187-0. ISBN 9780323401814.
- ^ Cetinkaya Y, Falk P, Mayhall GC (octombrie 2000). „Vancomycin-Resistant Enterococci”. Clin Microbiol Rev (în engleză). 13 (4): 686–707. doi:10.1128/cmr.13.4.686-707.2000. PMC 88957 . PMID 11023964.
- ^ a b c Wanger A, Chavez V, Huang RSP, Wahed A, Actor JK, Dasgupta A. (2017). „Antibiotics, Antimicrobial Resistance, Antibiotic Susceptibility Testing, and Therapeutic Drug Monitoring for Selected Drugs”. Microbiology and Molecular Diagnosis in Pathology, 119–153. doi:10.1016/b978-0-12-805351-5.00007-7
- ^ Emanuel Goldman, Lorrence H. Green (). „Antibiotic Susceptibility Testing”. Practical handbook of microbiology (ed. 3). Boca Raton, FL: CRC Press. Taylor & Francis Group. p. 211. ISBN 9781466587397.
- ^ a b Khan ZA, Siddiqui MF, Park S (). „Current and Emerging Methods of Antibiotic Susceptibility Testing”. Diagnostics (Basel) (în engleză). 9 (2): 49. doi:10.3390/diagnostics9020049. PMID 31058811. PMC 6627445
- ^ a b Wiegand I, Hilpert K, Hancock REW (). „Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances”. Nature Protocols (în engleză). 3 (2): 163–175. doi:10.1038/nprot.2007.521. PMID 18274517.
- ^ Chang, Hsein Chang; Chang, Jui Jung; Chan, Shih Huang; Huang, Ay Huey; Wu, Tsu Lan; Lin, Miao Chu; Chang, Tsung Chain (). „Evaluation of Etest for Direct Antifungal Susceptibility Testing of Yeasts in Positive Blood Cultures”. Journal of Clinical Microbiology. 39 (4): 1328–1333. doi:10.1128/JCM.39.4.1328-1333.2001. ISSN 0095-1137. PMC 87934 . PMID 11283051.
- ^ Yourassowsky E, van der Linden MP, Schoutens E (). „Use and interpretation of Schlichter's test on Haemophilus influenzae: relation of in vitro to in vivo results for cefamandole”. Journal of Clinical Pathology (în engleză). 32 (9): 956–959. doi:10.1136/jcp.32.9.956. PMC 1145859 . PMID 315967.
Bibliografie
modificare- În limba română
- Angelescu M (). Terapia cu antibiotice. București: Editura Medicală.
- Balș M. (). Antibioticele. București: Editura Medicală.
- Cionga E, Avram L (). „Antibiotice”. Medicamente chimioterapice. Cluj-Napoca: Editura Dacia.
- Cristea A.N. (). „Antibiotice și chimioterapice antimicrobiene”. Tratat de farmacologie (ed. 1). București: Editura Medicală. pp. 955–1057. ISBN 973-39-0535-6.
- L. Debeleac (). Microbiologie. București: Ed. Medicală Amaltea. ISBN 973-9628-60-5.
- O.M. Dorobăț (). Bacteriologie medicală. București: Editura Universității „Titu Maiorescu”. ISBN 973-7674-00-6.
- Fulga I.G. (). Antibioza, antibiotice, antibioterapie. București: Editura Medicală.
- În limba engleză
- Alcamo IE (). Fundamentals of microbiology. Boston: Jones and Bartlett. ISBN 978-0-7637-1067-5.
- Atlas RM (). Principles of microbiology. St. Louis: Mosby. ISBN 978-0-8016-7790-8.
- Gualerzi CO, Brandi L, Fabbretti A, Pon CL, ed. (). Antibiotics: Targets, Mechanisms and Resistance. John Wiley & Sons, Inc. ISBN 978-3-527-33305-9.
- Katzung, Bertram (). „VIII. Chemotherapeutic Drugs”. Basic and Clinical Pharmacology (ed. 14). McGraw-Hill Education. pp. 792–1002. ISBN 978-1259641152.
- Sköld O (). Antibiotics and Antibiotic Resistance. John Wiley & Sons, Inc. doi:10.1002/9781118075609. ISBN 9781118075609.
- Walsh C (). Antibiotics: Actions, Origins, Resistance. Washington DC: ASM Press. ISBN 978-1555818937.
- În limba germană
- Claus Simon, Wolfgang Stille: Antibiotika-Therapie in Klinik und Praxis. Schattauer, Stuttgart 1985, ISBN 3-7945-1970-1
- Wolfgang Stille, Hans-Reinhard Brodt, Andreas H. Groll, Gudrun Just-Nübling: Antibiotika-Therapie. 1. Nachdruck der 11. Auflage, Schattauer, Stuttgart 2006, ISBN 3-7945-2160-9.
Lectură suplimentară
modificare- Gould, K (). „Antibiotics: From prehistory to the present day”. Journal of Antimicrobial Chemotherapy. 71 (3): 572–575. doi:10.1093/jac/dkv484. PMID 26851273.
- Davies J, Davies D (septembrie 2010). „Origins and evolution of antibiotic resistance”. Microbiology and Molecular Biology Reviews. 74 (3): 417–33. doi:10.1128/MMBR.00016-10. PMC 2937522 . PMID 20805405.
- Giedraitienė A, Vitkauskienė A, Naginienė R, Pavilonis A (). „Antibiotic resistance mechanisms of clinically important bacteria”. Medicina. 47 (3): 137–46. doi:10.3390/medicina47030019. PMID 21822035.
- Pugh R, Grant C, Cooke RP, Dempsey G (august 2015). „Short-course versus prolonged-course antibiotic therapy for hospital-acquired pneumonia in critically ill adults”. The Cochrane Database of Systematic Reviews (8): CD007577. doi:10.1002/14651858.CD007577.pub3. PMID 26301604.PMC 7025798
Vezi și
modificareLegături externe
modificareMateriale media legate de antibiotice la Wikimedia Commons
- en Antibiotice de la Curlie
- en Alliance for the Prudent Use of Antibiotics apua.org
- en Ghidul antibioticelor drugs.com
- en O prezentare vizuală asupra claselor de antibiotice compoundchem
- ro Top 10 antibiotice naturale, Doctorul zilei
- ro Antibiotice și chimioterapeutice antibacteriene academia.edu
- ro O scurtă istorie a descoperirii antibioticelor și a evoluției rezistenței la antibacteriene medihub.ro